Shigatoxineproducerende Escherichia coli (STEC (Shigatoxineproducerende E. coli-stammen)), met als meest bekende serogroep O157, is een bekende verwekker van maagdarmklachten met symptomen variërend van ongecompliceerde diarree tot hemorragische colitis en het hemolytisch-uremisch syndroom (HUS (hemolitisch uremisch syndroom)). In 2011 zijn er 70 patiënten met een STEC O157-infectie gemeld. Er werden daarnaast 185 patiënten gemeld waarbij een STEC non-O157-infectie bevestigd kon worden. Drie kinderen met een STEC O157-infectie en 7 patiënten met een STEC non-O157-infectie ontwikkelden het hemolytisch-uremisch syndroom (HUS), waarvan 4 gerelateerd aan de Duitse STEC O104- uitbraak. Ten slotte werden er nog 589 patiënten gemeld waarbij de STEC-infectie niet op het RIVM bevestigd kon worden.
content
Auteur(s): I.H.M. Friesema, W.K. van der Zwaluw, E.G. Biesta-Peters, S. Kuiling, W. van Pelt
Infectieziekten Bulletin, jaargang 24, nummer 3, maart 2013
Vanwege de ernst van de ziekte, vooral bij kleine kinderen en ouderen, en het risico op grootschalige uitbraken, is in Nederland in januari 1999 een intensieve surveillance van STEC (Shigatoxineproducerende E. coli-stammen) O157 van start gegaan en zijn in december 1999 STEC-infecties opgenomen als meldingsplichtige ziekte. In 2007 is de surveillance uitgebreid met STEC-non-O157, waarbij opgemerkt moet worden dat niet alle Nederlandse laboratoriatechnieken gebruiken die het mogelijk maken STEC-non-O157 te detecteren. In dit artikel presenteren we de resultaten van de surveillance voor het jaar 2011.
Methoden
Cases
Binnen de aangifteplicht dient elke positieve bevinding van STEC (op basis van fecesonderzoek of serologie) door het laboratorium gemeld te worden aan de lokale GGD (Gemeentelijke Gezondheidsdienst). Daarnaast worden de laboratoria gevraagd om mogelijk STEC-positieve E. coli (Escherichia coli)-isolaten op te sturen naar het RIVM. Op het RIVM worden alle ingestuurde E. coli O157 en mogelijke STEC-non-O157-isolaten met behulp van PCR (polymerase chain reaction) (polymerase chain reaction) getest op de aanwezigheid van de belangrijkste virulentiegenen (Shigatoxine (stx (shigatoxine)) genen, E. coli attaching-and-effacinggen (eae (E. coli attaching-and-effacing)) en het EHEC (Enterohemorragische Escherichia coli)-hemolysinegen (e-hly (hemolysin))) en vervolgens getypeerd middels O- en H- serotypering. Tenslotte worden DNA (deoxyribonucleic acid) fingerprints van STEC-O157-isolaten gemaakt door middel van pulsed-field gel electroforese (PFGE (pulsed-field gel electroforese)).
De GGD verzamelt de basisinformatie over het klinische beeld bij de patiënt en blootstelling aan bekende risicofactoren en geeft dit via Osiris, het officiële meldingsportaal, door aan het RIVM. Daarnaast wordt, waar mogelijk, een langere vragenlijst afgenomen waarin dieper ingegaan wordt op klinisch beeld, gebruik van de gezondheidszorg en risicofactoren. Bij een vermoeden van een bron wordt contact opgenomen met de Nederlandse Voedsel en Waren Autoriteit (NVWA (Nederlandse Voedsel- en Warenautoriteit)) voor monstername van levensmiddelen, bemonstering van dierlijke bronnen of omgeving voor onderzoek naar STEC, en typering van eventuele isolaten. Voor een uitgebreidere beschrijving van de methode verwijzen we u naar onze eerdere publicatie.(1)
Resultaten
Meldingen algemeen
In 2011 werden 844 patiënten via de aangifte en/of het insturen van een isolaat gemeld. (Tabel 1) Van 453 van de 844 patiënten werden isolaten naar het RIVM gestuurd, waarvan bij 255 de aanwezigheid van stx-genen in de ingestuurde isolaten kon worden bevestigd. Er zijn 15 patiënten gemeld die HUS (hemolitisch uremisch syndroom) ontwikkelden. Bij 3 patiënten (0, 2 en 3 jaar) werd een STEC-O157-infectie vastgesteld. Onder de 7 patiënten met een STEC-non-O157-infectie behoorden er 4 tot de STEC-O104-uitbraak in Duitsland (leeftijd: 0, 27, 34 en 71 jaar); de overige 3 hadden een STEC-O5 (2 jaar), O26 (2 jaar) en -O83 (56 jaar)-infectie. De 5 HUS-patiënten zonder serotypering waren 2, 6, 8, 11 en 73 jaar.
|
|
Aantal gemelde patiënten (HUS) |
||
|---|---|---|---|
|
Indeling STEC-infecties |
2011 |
2010 |
2009 |
|
Geen bevestiging STEC- infecties |
589 (5) |
366 (4) |
238 (5) |
|
Alleen Osiris-melding |
391 (4) |
163 (3) |
76 (3) |
|
Onbevestigd isolaat/isolaten† |
198 (1) |
203 (1) |
162 (2) |
|
Bevestigde STEC-infecties |
255 (10) |
132 (3) |
108 (1) |
|
STEC-O157 |
70 (3) |
51 (2) |
57 (1) |
|
STEC-non-O157 |
185 (7) |
81 (1) |
51 (0) |
|
Totaal |
844 (15) |
498 (7) |
346(6) |
* HUS = hemolytisch-uremisch syndroom; † aanwezigheid van Shigatoxinegenen werd niet door het RIVM bevestigd. |
|
|
Geen serotypering |
STEC-non-O157 |
STEC-O157 |
|---|---|---|---|
|
N |
589 |
185 |
70 |
|
Geslacht: vrouw |
56% |
61% |
67% |
|
Leeftijd: |
|
|
|
|
0-4 jaar |
11% |
16% |
24% |
|
5-19 jaar |
14% |
20% |
24% |
|
20+ jaar |
75% |
64% |
52% |
|
Mediaan (range) |
42(0-97) |
28(0-87) |
20(0-85) |
|
Symptomen: n (n/N) |
457(78%) |
112(61%) |
62(89%) |
|
Alleen buikpijn |
12% |
17% |
0% |
|
Diarree (zonder bloed) |
67% |
54% |
32% |
|
Bloed in de ontlasting |
21% |
29% |
68% |
|
Ziekenhuisopname |
54/416(13%) |
26/116(22%) |
19/61(31%) |
|
Dagen tussen eerste ziektedag en diagnose met Osirismelding: n |
473 |
117 |
62 |
|
0-14 dagen |
37% |
48% |
76% |
|
15-28 dagen |
14% |
11% |
13% |
|
29-44 dagen |
7% |
14% |
3% |
|
45+ dagen |
11% |
11% |
0% |
|
onbekend |
31% |
16% |
8% |
|
Mediaan (range) |
13(0-623) |
12(2-452) |
7(1-30) |
In totaal werden 652 van de 844 patiënten (77%) gemeld via de aangifte, waarbij het laboratorium in 78% van de gevallen binnen 24 uur de positieve bevinding aan de GGD had doorgegeven. Van 192 patiënten werd alleen een isolaat ingestuurd, zonder een officiële melding via Osiris; het betrof 8 patiënten met een STEC-O157-infectie (8/70=11%), 68 met een STEC-non-O157-infectie (37%) en 116 van wie het ingestuurde isolaat niet als STEC bevestigd kon worden op het RIVM (59%). Er zijn meer vrouwen met een STEC-infectie dan mannen, vooral onder de STEC-O157-infecties (tabel 2). De patiënten zonder verdere typering zijn gemiddeld het oudst met 75% van deze patiënten 20 jaar of ouder. Het hoogste percentage kinderen is te zien in de groep met een STEC-O157-infectie. De patiënten met een STEC-O157-infectie hebben het vaakst bloed in de ontlasting en worden regelmatig in het ziekenhuis opgenomen (31%; 1999-2010: 33%-54%). Van de meerderheid van de STEC-O157-patiënten was een eerste ziektedag en diagnosedatum bekend, waarbij er nooit meer dan 30 dagen tussen beide data zat. Bij de 2 andere groepen (STEC-non-O157 en niet-bevestigde STEC-infecties) zit er meestal meer tijd tussen en waren de data vaker onbekend.
Mogelijke bronnen van infectie
In een aantal gevallen werd de NVWA op de hoogte gesteld van de STEC-infectie en verrichtte in 7 gevallen brononderzoek. Meestal betrof het monsternames van een vergelijkbaar product, omdat er geen restant meer aanwezig was. De kans op een positieve bevinding wordt hierdoor verlaagd. Het ging 4 keer om een patiënt met een onbevestigde STEC-infectie, waarbij metworst, kip, filet americain, en cervelaat en tomaten werden onderzocht. In geen van de monsters werd STEC aangetroffen. Op basis van een STEC O126 infectie werd geitenmelkpoeder onderzocht, waarin geen STEC werd aangetoond, maar het product wel verontreinigd bleek te zijn met andere bacteriën. Ten slotte deed de NVWA onderzoek bij twee STEC O157-infecties, waarbij saté met satésaus en filet americain, biefstuk en salades werden getest. In de kipsaté, de vleesmonsters en kiemgroente werden wel E. coli- bacteriën aangetroffen, maar geen STEC.
STEC O157
In 2011 zijn er 70 patiënten met een STEC-O157-infectie gemeld, wat neerkomt op 0,42 per 100.000 inwoners. Dat is iets hoger dan voorgaande jaren: 32-57 patiënten per jaar of 0,22-0,35 ziektegevallen per 100.000 inwoners, exclusief de landelijke uitbraken.
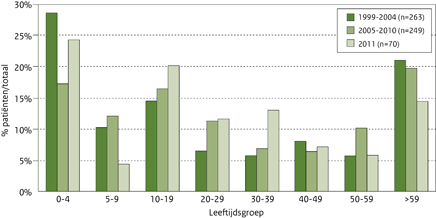
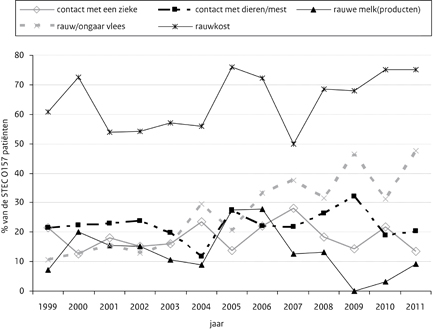
Bij vergelijking van de leeftijdsverdeling binnen de STEC-O157-infecties valt op dat het percentage jonge kinderen (0-4 jaar) in 2011 bijna even hoog is als in de periode 1999-2004 (figuur 1a). Het aandeel van de 30-39 jarigen lijkt het sterkst gestegen te zijn. Gemiddeld over de periode 1999-2010 lag de piek van zieken gedurende het jaar in juli (16%) en augustus (19%). In 2011 lag de piek in augustus (20%) en september (26%).Van 44 patiënten werd een vragenlijst ingestuurd (63%). Consumptie van rauwe melk(producten) werd weer vaker genoemd in 2009 en 2010 (figuur 2). Ook het aantal patiënten dat rauw of ongaar vlees heeft gegeten is gestegen.
De isolaten van alle 70 STEC-O157-patiënten bevatten het stx2-gen, 49 (70%) daarvan bevatten daarnaast het stx1-gen. Alle O157-isolaten bevatten het H7-gen, of dit gen ook tot expressie komt, is in 2011 niet getest. Eén isolaat (stx2 positief) was sorbitolpositief. Ten slotte hadden alle isolaten het eae- en het e-hly-gen.
Figuur 1a Percentage patiënten per leeftijdsgroep voor STEC-O157, exclusief de patiënten van de uitbraken in 2005, 2007 en 2009
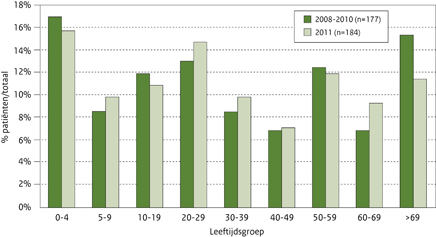
Figuur 1b Percentage patiënten per leeftijdsgroep voor STEC-non-O157
Met behulp van PFGE kunnen 10 clusters in 2011 onderscheidenworden, variërend van 2 tot 13 personen per cluster. Bij 6 clusters (4x 2 patiënten, 3 en 4 patiënten) was een gemeenschappelijke bron niet aannemelijk door de spreiding in tijd of regio. Bij het zevende cluster waren beide patiënten in Turkije geweest, met ruim een maand tussen de eerste ziektedagen en geen verder informatie over de verblijfplaats. Bij het achtste cluster had de ene patiënt de infectie vermoedelijk in Griekenland opgelopen en waren er geen gegevens bekend van de andere patiënt; de diagnose werd wel rond dezelfde datum gesteld. Het negende cluster bestaat uit 3 patiënten waarvan 2 uit een gezin, de derde patiënt was wel in dezelfde periode ziek geworden maar woont in een andere regio. Het laastste cluster bestaat uit 13 patiënten met het aantal dagen tussen de eerste ziektedagen variërend van 1 tot 40 dagen. De patiënten komen voornamelijk uit 3 regio’s. De eerste patiënt heeft de besmetting vermoedelijk in Spanje opgelopen. Er zijn geen verdere aanwijzingen voor een gezamenlijke bron, behalve dat de volgende 3 patiënten alle 3 filet américain gegeten hebben, waarbij 2 van de 3 uit dezelfde gemeente komen. Echter, er was geen overeenkomst in winkel(keten) waar de filet américain gekocht was. Twee kinderen uit 1 gezin die ziek waren geworden, bleken een O157-infectie met een verschillend PFGE-patroon te hebben; beide infecties zijn vermoedelijk in Turkije opgelopen. Bij 1 patiënt bleek het PFGE-patroon van 2 isolaten uit 1 fecesmonster niet hetzelfde te zijn.
Figuur 2 Percentage STEC-O157-patiënten per risicofactor per jaar (1999-2011), exclusief de STEC-O157-patiënten van de uitbraken in 2005, 2007 en 2009
STEC-non-O157
Er werden in totaal 185 patiënten gemeld waarbij een STEC-non-O157-infectie bevestigd kon worden. Aangezien niet alle laboratoria testmethodes gebruiken waarmee alle STEC gedetecteerd kunnen worden, kan de incidentie niet rechtstreeks berekend worden. In 2011 gebruikten 20 van de 31 insturende laboratoria een methode waarmee alle STEC gedetecteerd kan worden. Deze laatste laboratoria waren verantwoordelijk voor 78% van de bevestigde STEC-O157-meldingen. De verhouding O157:non-O157 binnen deze laboratoria is 1:3,5. Omgerekend naar heel Nederland zou dit voor 2011 uitkomen op zo’n 230 STEC-non-O157-infecties wat correspondeert met een incidentie van 1,4 ziektegevallen per 100.000 inwoners.
De leeftijdsverdeling van de patiënten met een STEC-non-O157-infectie in 2011 is vergelijkbaar met die in de periode 2008-2010. (Figuur 1b) De grootste groep wordt gevormd door de 0-4 jarigen, maar de verschillen tussen de leeftijdsgroepen is minder groot dan bij de STEC-O157-infecties. De piek van zieken lag in 2008-2010 in juli tot en met augustus (elk 14% van de zieken). In 2011 waren er 3 relatief losse pieken: mei (14%), juli (12%) en september (14%). Van 51 patiënten werd een vragenlijst ingestuurd (28%). De rapportage van blootstelling aan de 5 risicofactoren - consumptie van rauw of ongaar vlees, van rauwe melk(producten) en van rauwkost, en contact met dieren en met een zieke voor het zelf ziek worden - is vergelijkbaar voor de patiënten met een STEC-O157- en een STEC-non-O157-infectie. Het grootste verschil is te zien voor contact met een zieke als mogelijk risico voor het zelf ziek worden, dat genoemd werd door respectievelijk 22% en 15% van de STEC-non-O157 en O157-patiënten. Dit verschil is niet statistisch significant.
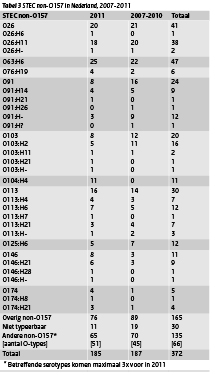
Van de 185 STEC-non-O157-isolaten bevatten 70 (38%) isolaten alleen het stx1-gen, 96 (52%) isolaten alleen het stx2-gen (waarvan 44 (24%) het stx2f-gen) en 19 (10%) isolaten bevatten beide genen. In totaal 41 (22%) isolaten hadden het eae- en het e-hly-gen, 46 (25%) isolaten hadden alleen het eae-gen, 45 (24%) isolaten alleen het e-hly-gen en 53 (29%) isolaten geen van beide genen. Van de 185 STEC-non-O157-isolaten was 11 keer de O-groep niet typeerbaar. Bij de overige 174 isolaten werden 51 verschillende O-groepen gevonden. De 10 meest gevonden O-groepen in 2011 staan vermeld in tabel 3. De 3 meest gevonden O-groepen in 2011 waren O63, O26 en O113. In 2008 en 2010 stond O63 ook op de eerste plek en O26 komt elk jaar voor in de top 3. O104:H4 staat in 2011 op de vierde plek met 11 patiënten, deze zijn allen gerelateerd aan de uitbraak van Enterohemorragische Escherichia coli (EHEC) in Duitsland. (3)
Tabel 3 STEC-non-O157 in Nederland, 2007-2011 (klik voor een grotere afbeelding op het plaatje)
* Betreffende serotypes komen maximaal 3x voor in 2011 |
Discussie
De incidentie van laboratoriumbevestigde STEC-O157 lag in 2011 met 0,42 ziektegevallen per 100.000 inwoners iets hoger dan in voorgaande jaren (0,22-0,35 per 100.000 inwoners (exclusief uitbraken)). Tariq en collega’s (2) hebben een schatting gemaakt van de kosten rondom STEC-O157-infecties in Nederland. Als iemand diarreeklachten eeft als gevolg van een STEC-infectie, zonder complicaties en ziekenhuisopname, dan kost een dergelijke episode gemiddeld 126 euro, ontwikkelt iemand vervolgens HUS dan komen de kosten uit op 25.713 euro. Deze kosten zijn voornamelijk gerelateerd aan de gezondheidszorg: bezoek aan huisarts, ziekenhuisopname en medicatie. In totaal kosten STEC-O157-infecties naar schatting 4,5 tot 9,1 miljoen euro per jaar. Of het gaat om een stijgende trend in de incidentie of een eenmalige piek bijvoorbeeld doordat meer diagnostiek werd uitgevoerd in verband met de O104 crisis, zal de komende jaren moeten worden bezien. Het absolute aantal STEC-non-O157-infecties stijgt elk jaar. Echter, de verhouding O157:non-O157 binnen de laboratoria die testmethodes gebruiken waarmee alle STEC gedetecteerd kunnen worden, blijft tussen 1:3,5 en 1:4,0 behalve in 2010 (1:2,3). (1, 4) Omgerekend naar heel Nederland zou dit in 2011 neerkomen op een incidentie van 1,38 ziektegevallen per 100.000 inwoners. Dit is iets hoger dan berekend over de jaren 2008-2010 (0,72-1,21 per 100.000).
De hier gegeven incidenties van STEC-O157 en non-O157 zullen onderschattingen zijn van de werkelijke incidenties, omdat niet iedereen zo ziek zal worden dat hij een arts bezoekt, een arts niet altijd diagnostiek zal aanvragen en bij een laboratoriumaanvraag niet altijd onderzoek gedaan zal worden naar STEC. Ook kan 44% van de 453 naar het RIVM ingestuurde isolaten niet bevestigd en dus niet getypeerd worden en is niet meegeteld. In de periode 2008-2010 kon zelfs ruim 60% van de ingestuurde isolaten niet bevestigd worden. Alleen getypeerde isolaten worden meegenomen in de incidentiebepaling. Het weglaten van de niet getypeerde isolaten uit deze berekening leidt enerzijds tot een verdere onderschatting. Anderzijds rapporteerden Urdahl et al (5) dat in de ontlasting van 14% van 165 vrijwilligers stx-genen werd aangetoond met behulp van polymerase chain reaction (PCR). Er werd geen relatie gevonden met leeftijd, geslacht, reizen of diarreeklachten. Slechts in één van deze gevallen kon een STEC aangetoond worden. Mogelijk dat stx-genen en zelfs STEC als passant in kleine hoeveelheiden in de normale darmflora kan worden gevonden zonder infectie te veroorzaken. Bij dieren wordt STEC als onderdeel van de normale darmflora beschouwd. (6)
Hoewel er 10 clusters binnen de STEC-O157-infecties op basis van PFGE gevonden werden, was over het algemeen een gemeenschappelijke bron niet aannemelijk. Dit zou kunnen komen, doordat patiënten zich niet alles meer herinneren wat ze gegeten of gedaan hebben. Aangezien voornamelijk rundvee het reservoir van STEC is, kan het risico op ziekte onder andere verkleind worden door voorzichtig te zijn met consumptie van rauw of ongaar vlees en te letten op hygiëne tijdens voedselbereiding.
Vooral bij de patiënten waarbij er geen STEC gekweekt en getypeerd kon worden, lijken de klachten minder acuut en ernstig te zijn. Maar ook bij STEC-non-O157 verloopt de infectie gemiddeld minder ernstig dan bij een STEC-O157-infectie. STEC-non-O157 is echter een heterogene groep pathogenen, met STEC-O-typen die wel een ernstig infectie kunnen veroorzaken. Bijvoorbeeld de 11 patiënten met een STEC-O104, gerelateerd aan de Duitse uitbraak (3), waarvan er 4 HUS ontwikkelden. Daarnaast waren er in 2011 ook HUS-patiënten bij wie een STEC-O5, O26 of O83 werd gevonden. Wereldwijd zijn O26, O103, O111 en O145 de meest bekende types naast O157 (7, 8). In Nederland waren O63, O26 en O113 de 3 meest gevonden O-groepen in 2011. Bijzonder aan O63 is dat dit type altijd hetstx2f-gen bezat. Tot voor kort werd aangenomen dat stx2f niet belangrijk was voor humane infecties en vrijwel alleen voorkwam bij duiven. (9) In totaal bezaten in de periode 2008-2011 22-27% van de op het RIVM getypeerde STEC-non-O157 dit gen.
Door de invoering van de PCR is het aantal meldingen van STEC aanzienlijk gestegen, waarbij in een grote groep de STEC uiteindelijk niet gekweekt kan worden. Ook ontstaat er steeds meer twijfel of alle STEC-positieve PCR-resultaten relevant zijn voor de publieke gezondheid (geen duidelijke klachten, geen acute klachten). Momenteel worden er, voornamelijk op lokaal of regionaal niveau, pragmatische keuzes gemaakt welke STEC-positieve PCR-resultaten wel en welke niet relevant zijn. Daarom wordt er gewerkt aan 2 gekoppelde projecten in 2 regio’s, een laboratoriumdiagnostiekproject en een GGD-project, om een wetenschappelijk onderbouwd keuze algoritme op te stellen en waar nodig richtlijnen aan deze keuzes aan te passen. Het laboratoriumdiagnostiekproject is al gestart en het GGD-project zal waarschijnlijk begin 2013 starten. De resultaten van beide projecten worden in 2014 verwacht.
Geconcludeerd wordt dat STEC-non-O157-infecties in Nederland wat betreft incidentie minstens zo belangrijk zijn als STEC-O157-infecties. Wat betreft ziektelast lijken de STEC-non-O157-infecties gemiddeld een minder ernstig verloop te hebben, wat echter mede afhankelijk is van welke O-groepen gevonden worden.
Wij bedanken alle GGD-en en medisch microbiologische laboratoria hartelijk voor hun medewerking bij de verzameling van de patiëntgegevens en het insturen van isolaten. Ook bedanken we de medewerkers van de NVWA voor het onderzoek naar landbouwhuisdieren en verdacht voedsel.
Auteurs
I.H.M. Friesema 1, W.K. van der Zwaluw 1, E.G. Biesta-Peters 2, S. Kuiling 2, W. van Pelt 1
1. Centrum Infectieziektebestrijding, RIVM, Bilthoven
2. Nederlandse Voedsel en Waren Autoriteit, Wageningen
Correspondentie
I.H.M. Friesema | ingrid.friesema@rivm.nl
- Friesema IHM, de Jager CM, Heuvelink AE (alveolaire echinokokkose), et al. Intensieve surveillance van STEC (Shigatoxineproducerende E. coli-stammen) in Nederland, 2010. Infectieziekten Bulletin 2011; 22: 370-4.
- Tariq L, Haagsma J, Havelaar A. Cost of Illness and Disease Burden in The Netherlands Due to Infections with Shiga Toxin-Producing Escherichia coli O157. J Food Prot 2011; 74: 545-52.
- Frank C, Werber D, Cramer JP, et al. Epidemic profile of Shiga-toxin-producing Escherichia coli O104:H4 outbreak in Germany. N Engl J Med 2011; 365: 1771-80.
- Van Duynhoven YTHP, Friesema IHM, Schuurman T, et al. Prevalence, characterization and clinical profiles of Shiga toxin-producing Escherichia coli in the Netherlands. Clin Microbiol Infect 2008; 14: 437-45.
- Urdahl AM, Solheim HT, Vold L, Hasseltvedt V, Wasteson Y. Shiga toxin-encoding genes (stx (shigatoxine) genes) in human faecal samples. APMIS 2012; doi: 10.1111/j.1600-0463.2012.02957.x [Epub ahead of print].
- Duffy G, Garvey P, McDowell DA. Verocytotoxigenic E.coli. Trumbull, Connecticut, USA (United States of America): Food & Nutrition press, Inc.; 2001.
- Perelle S, Dilasser F, Grout J, Fach P. Screening food raw materials for the presence of the world’s most frequent clinical cases of Shiga toxin-encoding Escherichia coli O26, O103, O111, O145 and O157. International Journal of Food Microbiology 2007; 113: 284-8.
- Johnson KE, Thorpe CM, Sears CL. The emerging clinical importance of non-O157 shiga toxin-producing Escherichia coli. Clin Infect Dis 2006; 43: 1587-95.
- Prager R, Fruth A, Siewert U, Strutz U, Tschape H. Escherichia coli encoding Shiga toxin 2f as an emerging human pathogen. Int J Med Microbiol 2009; 299: 343-53.