Meningokokkenziekte wordt veroorzaakt door de gramnegatieve bacterie Neisseria meningitidis ofwel de meningokok. De bacterie bevindt zich gewoonlijk in de neus-keelholte van gezonde mensen, zonder ziekteverschijnselen te veroorzaken. Als de bacterie in de bloedbaan komt of de hersenvliezen aantast, kan dit ernstige ziekte tot gevolg hebben zoals sepsis en meningitis. Vanwege het snelle ziektebeloop en de soms atypische symptomen in het begin, wordt meningokokkenziekte niet altijd op tijd herkend wat mede bijdraagt aan de relatief hoge sterfte (8%). (1) Ook houden veel patiënten er zeer ernstige restverschijnselen aan over zoals doofheid, amputatie van ledematen met gangreen en hersenbeschadiging (6%). (1) Sinds oktober 2015 is er in Nederland een plotselinge toename van het aantal patiënten met meningokokkenziekte veroorzaakt door serogroep W (menW (meningokokken groep W)). Het absolute aantal menW-infecties is vooralsnog beperkt. In dit artikel beschrijven we de toename van menW en plaatsen dit in de context van de huidige menW-uitbraak in Groot-Brittannië. (2) Daarnaast bespreken we verschillende mogelijkheden om het vaccinatieprogramma tegen meningokokkenziekte in Nederland aan te passen aan de huidige epidemiologische status.
IB januari 2017
Auteurs: M.J. Knol, W.L.M. Ruijs, H.E. de Melker, G.A.M. Berbers, A. van der Ende
Infectieziekten Bulletin, jaargang 28, nummer 1, januari 2017
Achtergrond
Door verschillen in het kapselpolysacharide van de meningokok kunnen 12 verschillende serogroepen worden onderscheiden, waarvan A, B, C, E, W, X, Y en Z in Nederland voorkomen. (3) In 2001 was er in Nederland een sterke toename van het aantal patiënten met meningokokkenziekte veroorzaakt door serogroep C (menC (meningokokken groep C)) en waren er meerdere kleine clusters verspreid over het land. (4) Dit leidde ertoe dat er in 2002 (juni-december) een grootschalige landelijke vaccinatiecampagne is uitgevoerd waarbij kinderen van 14 maanden tot en met 18 jaar gevaccineerd werden met een geconjugeerd menC-vaccin. Daarnaast werd in september 2002 menC-vaccinatie op de leeftijd van 14 maanden opgenomen in het Rijksvaccinatieprogramma (RVP (Rijksvaccinatie programma)). Hierna was er een snelle en sterke afname van het aantal menC-patiënten te zien, zowel in de gevaccineerde - als de ongevaccineerde bevolking (als gevolg van groepsimmuniteit). (5, 6).
Surveillance van meningokokkenziekte
De surveillance van meningokokkenziekte wordt al lange tijd uitgevoerd door het Nederlands Referentie Laboratorium voor Bacteriële Meningitis (NRLBM (Nederlands Referentie Laboratorium voor Bacteriële Meningitis)) in het Academisch Medisch Centrum (AMC (Academisch Medisch Centrum Amsterdam)) Amsterdam samen met het Rijksinstituut voor Volksgezondheid en Milieu (RIVM). Sinds 1959 sturen de medisch microbiologische laboratoria op vrijwillige basis isolaten uit bloed of liquor die positief zijn voor Neisseria meningitidis, naar het NRLBM. Van deze isolaten wordt de serogroep bepaald. Daarnaast vindt verdere typering plaats met DNA (deoxyribonucleic acid)-sequenties die coderen voor variabele regio’s van respectievelijk het PorA- en FetA-eiwit. Zonder een beschikbaar isolaat, kan ook materiaal ingestuurd worden dat met PCR (polymerase chain reaction) positief testte voor Neisseria meningitidis. Hieruit kan met behulp van RT (Real Time)-PCR met serogroepspecifieke probes vaak toch de serogroep bepaald worden. Het NRLBM test ook gevoeligheid voor penicilline en rifampicine.
Meningokokkenziekte is een meldingsplichtige ziekte sinds 1905. De GGD (Gemeentelijke Gezondheidsdienst) moet gemeld worden als een patiënt tenminste 1 van de volgende symptomen heeft: koorts, meningeale prikkeling, petechiën, septische shock of septische artritis, in combinatie met een door het laboratorium bevestigde Neisseria meningitidis-besmetting (positieve kweek of PCR voor Neisseria meningitidis of aantonen van gramnegatieve Neisseria meningitidis-bacteriën in normaal steriele plaats). Na de melding start de GGD met contactonderzoek. Huisgenoten en zeer nauwe contacten van de indexpatiënt krijgen zo snel mogelijk antibioticaprofylaxe. Wanneer er sprake is van een bewezen ziekte-geval van meningokokkenziekte door een serogroep A, C, W of Y is – naast chemoprofylaxe – vaccinatie van contacten aan te raden. (7)
De gegevens van het NRLBM en de meldingen aan de GGD worden sinds 2003 aan elkaar gelinkt om een zo compleet mogelijk beeld te hebben van de situatie.
Incidentie van meningokokkenziekte
Figuur 1 laat de incidentie van meningokokkenziekte per serogroep zien per epidemiologisch jaar (juli tot juni) van 1992/1993 tot 2015/2016:
- De incidentie van meningokokkenziekte door serogroep B (menB (meningokokkenziekte door serogroep B)) is het hoogst en laat een geleidelijke daling zien in de laatste 15 jaar.
- Voor menC is duidelijk de toename in 2000-2002 te zien van ongeveer 0,5/100.000/jaar (n=60-90 patiënten per jaar) vóór 2000 naar 1,1/100.000 (n=180) en 2,1/100.000 (n=333) in respectievelijk 2000/2001 en 2001/2002. Na de invoering van de menC-vaccinatie in 2002 is een sterke afname te zien naar, op dit moment, minder dan 10 patiënten per jaar (incidentie <0,5/100.000/jaar).
- De incidentie van meningokokkenziekte veroorzaakt door andere serogroepen, inclusief serogroep W, is erg laag gedurende de hele periode.
- De incidentie van meningokokkenziekte is het hoogst bij kinderen tot 5 jaar (2,5/100.000 in 2015).
- In 2001 en 2002 was de incidentie van menC ook hoog bij adolescenten van 10-19 jaar (5).
Figuur 1 Incidentie van meningokokkenziekte per serogroep per epidemiologisch jaar (juli-juni) van 1992/93 tot 2015/16.
Plotselinge toename menW (meningokokken groep W)
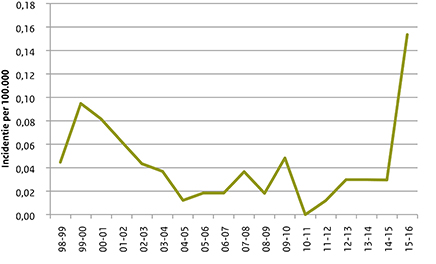
Figuur 2 laat de incidentie van menW zien per epidemiologisch jaar (juli-juni) van 1998/1999 tot en met 2015/2016. In 1999/2000 en 2000/2001 was er een kleine toename in de menW-incidentie. Deze toename was gerelateerd aan een uitbraak tijdens de Hadj in Saoedi-Arabië. (8) Van 2005/2006 tot 2014/2015 waren er gemiddeld 4 patiënten met menW per jaar (incidentie: 0,024/100.000/jaar). In het epidemiologische jaar 2015-2016 werden 26 menW-patiënten gemeld (incidentie: 0,153/100.000/jaar). In 2015-2016 was 23% (26/114) van alle gevallen van meningokokkenziekte toe te schrijven aan serogroep W, terwijl dit in de periode 2005/2006 tot 2014/2015 slechts 3% (40/1351) was.
In het huidige epidemiologische jaar 2016/2017 (tot en met november 2016) zijn 20 menW-patiënten gemeld. Dit is 34% van het totaal aantal patiënten met meningokokkenziekte. Hieronder geven we een wat uitgebreidere beschrijving van de situatie juli 2015-november 2016.
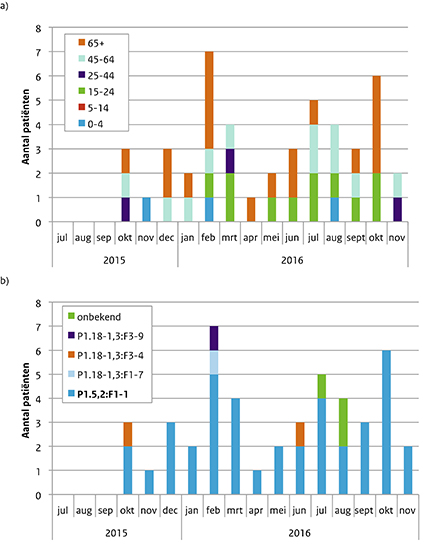
Van juli 2015 tot en met november 2016 werden 46 menW-patiënten gemeld (Figuur 3): 3 patiënten onder de 5 jaar (7%), 11 patiënten tussen 15 en 24 jaar (24%), 3 patiënten tussen 25 en 44 jaar (7%), 11 patiënten tussen 45 en 64 jaar (24%) en 18 patiënten van 65 jaar of ouder (39%) (Figuur 3a). Bij 43 patiënten kon het type bepaald worden en 39 (91%) van hen hadden type P1.5,2:F1-1 (Figuur 3b). Naast de verschillende typen kunnen meningokokken ook worden onderscheiden met multilocus sequence typing (MLST (multilocus sequence typing)) waarbij de DNA-volgorde wordt bepaald van 7 huishoudgenen van de meningokok. Een groep verwante stammen waarvan ieder isolaat 6 allelen bevat die identiek zijn aan de allelen van ten minste 1 ander lid van de groep, wordt een klonaal complex genoemd. Het type P1.5,2:F1-1 is geassocieerd met het hypervirulente klonaal complex 11. Na de typering bleek dat de P1.5,2:F1-1-isolaten inderdaad tot dit klonaal complex horen. Vier patiënten overleden (9%), een 19-jarige, 20-jarige, 61-jarige en een 67-jarige; zij hadden alle 4 dit type isolaat. Veertien patiënten hadden sepsis (35%), 8 patiënten hadden meningitis (20%) en 3 patiënten hadden sepsis en meningitis (8%). De overige 15 patiënten (38%) hadden atypische ziektebeelden zoals pneumonie (n=7; 18%), milde meningokokkemie (n=6; 15%) en septische artritis (n=2; 5%). Van 5 patiënten is het ziektebeeld niet bekend. De 4 overleden patiënten hadden allen sepsis.
Er is geen geografische clustering en er zijn voor zover bekend geen epidemiologisch gerelateerde patiënten. De meeste patiënten gaven aan dat zij waarschijnlijk in Nederland waren besmet (35/37). Een patiënt was mogelijk besmet in Spanje en een ander in Duitsland.
Van 50 menW-isolaten uit 2015 en 2016 waren er 46 gevoelig voor penicilline (MIC (Minimum inhibitory concentration) range: 0,03 – 0,06 mg/L (milligram per liter)) en 4 verminderd gevoelig (MIC range: 0,12 – 0,25 mg/L). Alle isolaten waren gevoelig voor rifampicine.
Figuur 2 Incidentie van meningokokkenziekte door serogroep W per epidemiologisch jaar van 1998/99 tot en met 2015/16.
Figuur 3 Leeftijd (a) en type (b) van de 37 patiënten met meningokokkenziekte serogroep W van 1 juli 2015 tot en met 30 november 2016.
MenW (meningokokken groep W)-uitbraak in Groot-Brittannië
Sinds 2011/2012 valt in Groot-Brittannië een stijging waar te nemen van het aantal menW-patiënten. (2) In het epidemiologische jaar 2014/2015 werden 176 patiënten gemeld (incidentie: 0,323/100.000); dit was 24% van alle patiënten met meningokokkenziekte. Dit percentage was 15% in 2013/2014, 7% in 2012/2013 en 1,7% in 2008/2009. In eerste instantie was er vooral een toename te zien van menW bij ouderen, maar al snel was de stijging bij alle leeftijdsgroepen zichtbaar, vooral bij adolescenten (15-19 jarigen) en zuigelingen (jonger dan 1 jaar). De menW-isolaten in Groot-Brittannië in 2014/2015 waren veelal van het PorB-serotype 2a, een surrogaatmarker voor het klonaal complex 11, en sterk gerelateerd aan het type P1.5,2:F1-1 dat we in Nederland zien. Het klonaal complex 11 is ook verantwoordelijk voor huidige menW-uitbraken in Zuid-Amerika. (9, 10) Het klinisch beeld van de patiënten in Groot-Brittannië was sepsis bij 49% van de patiënten, meningitis bij 12%, sepsis en meningitis bij 16%, en 25% van de patiënten had een atypisch ziektebeeld zoals pneumonie (12%), septische artritis (7%) en epiglottitis/supraglottitis (4%). In 2014/2015 was het overlijdenspercentage 12% (21/170), net zoals in vorige jaren. De helft van de patiënten die overleden waren ouder dan 65 (11), 6 patiënten waren 45-64 jaar, 2 van 18-30 jaar en 2 kinderen jonger dan 5 jaar.
In augustus 2015 werd vanwege de toename van het aantal patiënten met menW, de menC-boostervaccinatie die in het Britse vaccinatieprogramma aan 13-14 jarigen wordt gegeven, vervangen door het quadrivalente vaccin (menACWY (meningokokken groepen ACWY)), gecombineerd met een inhaalvaccinatieprogramma voor alle 13-18 jarigen. (2)
Atypisch ziektebeeld
Het is bekend dat meningokokkenziekte zich kan presenteren met een atypisch ziektebeeld zoals pneumonie, septische artritis, endocarditis en epiglottitis. In Groot-Brittannië werd echter tussen juli 2015-januari 2016 ook een gastro-intestinaal ziektebeeld gezien bij 7 van 15 menW-patiënten in de leeftijd van 15 tot 19 jaar. (11) De uiteindelijke diagnose bij deze 7 patiënten was sepsis (voor een gedetailleerde beschrijving van het ziektebeloop, zie literatuurverwijzing 11). Vijf van de 7 patiënten overleden.
Ook bij een recente menW-uitbraak in Chili met 58 patiënten werd dit gastro-intestinale ziektebeeld bij 14 patiënten gezien, 8 van hen overleden. (12)
Recent is in Nederland een eerste menW-patiënt gemeld met ernstige gastro-enteritis. Alertheid op dit atypische ziektebeeld is ook in Nederland geboden.
Vaccinatie tegen meningokokkenziekte in het Rijksvaccinatieprogramma
De invoering van de menC-vaccinatie in het RVP in combinatie met de massacampagne voor alle 1-18 jarigen, was een groot succes. Op dit moment is de incidentie van menC in Nederland nog steeds erg laag (Figuur 1). Uit serologisch onderzoek blijkt echter dat circulerende antistoffen in kinderen snel afnemen na hun vaccinatie op de leeftijd van 14 maanden. (13) Bij een snel verlopende ziekte als meningokokkenziekte zijn circulerende antistoffen van cruciaal belang om goede bescherming te waarborgen.
In Groot-Brittannië is het beleid over bescherming tegen meningokokkenziekte in 2015 aangepast door een menC-boostervaccinatie in te voeren voor 13-14-jarigen. (14) Ook al was de circulatie van menC destijds laag, net zoals op dit moment in Nederland. De achterliggende redenering hiervoor was dat meningokokkendragerschap het hoogst is bij adolescenten. (15) Vaccinatie van deze groep leidt tot directe bescherming en anderzijds worden andere leeftijdsgroepen indirect beschermd door een verminderd dragerschap dat leidt tot groepsimmuniteit. Een Nederlands onderzoek liet zien dat menC -boostervaccinatie op de leeftijd van 10, 12 of 15 jaar een zeer goede immuunrespons geeft. (16) Recent bleek dat deze boostervaccinatie ook na 3 jaar nog hoge antistofniveaus oplevert en dat langdurige bescherming (>50 jaar) vooral verwacht kan worden na vaccinatie op de leeftijd van 12 en 15 jaar. (17)
Gezien de ontwikkelingen bij zowel menW als menC moet het beleid over bescherming tegen meningokokkenziekte via het RVP herzien worden. Er zijn 2 conjugaatvaccins geregistreerd in Europa die beschermen tegen meningokokken serogroepen A, C, W en Y; 1 vaccin waarbij het serogroepspecifieke polysacharide geconjugeerd is aan tetanus toxoid (Nimenrix, voorheen GSK (GlaxoSmithKline), nu Pfizer) en 1 vaccin met CRM197 (een niet-toxische variant van difterietoxine) als dragereiwit (Menveo, voorheen Novartis, nu GSK). Beide vaccins induceren een goede immuunrespons tegen de 4 serogroepen. De immuunrespons tegen serogroep C van de menACWY-vaccins is vergelijkbaar met die van monovalente MenC (meningokokken C)-conjugaatvaccins en beide vaccins bieden een heel goede maat van bescherming. (18) (Van Ravenhorst e.a., manuscript in voorbereiding).
Conclusie
In Nederland is een plotselinge toename van meningokokkenziekte door serogroep W zichtbaar. Vanwege het soms atypische gastro-intestale ziektebeeld bij patiënten met menW in Groot-Brittannië, moeten artsen in Nederland alert zijn op dit atypische ziektebeeld. De toename van menW leidde in Groot-Brittannië tot de invoering van een menACWY-vaccinatie aan adolescenten. Het is van belang de recente epidemiologische ontwikkelingen mee te nemen in de afweging om het beleid in Nederland voor preventie van invasieve meningokokkenziekte aan te passen.
Auteurs
M.J. Knol1, W.L.M. Ruijs1, H.E. de Melker1, G.A.M. Berbers1, A. van der Ende2,3
1 Centrum voor Infectieziektebestrijding, Rijksinstituut voor Volksgezondheid en Milieu
2. Afdeling Medische Microbiologie, Academisch Medisch Centrum Amsterdam
3. Nederlands Referentie Laboratorium Bacteriële Meningitis, Academisch Medisch Centrum Amsterdam
Corresponderentie
- Stoof SP (Sustainable Procurement), Rodenburg GD (Gezondheidsdienst voor Dieren), Knol MJ, Rumke LW, Bovenkerk S, Berbers GA, et al. Disease Burden of Invasive Meningococcal Disease in the Netherlands Between June 1999 and June 2011: A Subjective Role for Serogroup and Clonal Complex. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America. 2015;61(8):1281-92.
- Campbell H, Saliba V, Borrow R, Ramsay M, Ladhani SN. Targeted vaccination of teenagers following continued rapid endemic expansion of a single meningococcal group W clone (sequence type 11 clonal complex), United Kingdom 2015. Euro surveillance : bulletin Europeen sur les maladies transmissibles = European communicable disease bulletin. 2015;20(28).
- Bijlsma MW, Bekker V, Brouwer MC (medisch centrum), Spanjaard L, van de Beek D, van der Ende A. Epidemiology of invasive meningococcal disease in the Netherlands, 1960-2012: an analysis of national surveillance data. The Lancet Infectious diseases. 2014;14(9):805-12.
- De Greeff SC, Van Vliet JA, De Melker HE. De huidige vaccinatiecampagne tegen Meningokokken C. Infectieziekten Bulletin. 2002;13(6):219-23.
- Bijlsma MW, Brouwer MC, Spanjaard L, van de Beek D, van der Ende A. A decade of herd protection after introduction of meningococcal serogroup C conjugate vaccination. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America. 2014;59(9):1216-21.
- de Greeff SC, de Melker HE, Spanjaard L, van den Hof S, Dankert J. [The first effect of the national vaccination campaign against meningococcal-C disease: a rapid and sharp decrease in the number of patients]. Nederlands tijdschrift voor geneeskunde. 2003;147(23):1132-5.
- LCI (Landelijke coördinatie infectieziektebestrijding) Richtlijn - Meningokokken-meningitis en -sepsis (meningokokkenziekte of meningokokkose). Bilthoven: RIVM; Oktober 2013.
- De verspreiding van de meningokok W135 in Nederland. Infectieziekten Bulletin. 2001;12(8):255-7.
- Abad R, Lopez EL, Debbag R, Vazquez JA. Serogroup W meningococcal disease: global spread and current affect on the Southern Cone in Latin America. Epidemiology and infection. 2014;142(12):2461-70.
- Lucidarme J, Hill DM (dystrophia myotonica), Bratcher HB (hepatitis b), Gray SJ, du Plessis M, Tsang RS (respiratoir syncytieel), et al. Genomic resolution of an aggressive, widespread, diverse and expanding meningococcal serogroup B, C and W lineage. The Journal of infection. 2015;71(5):544-52.
- Campbell H, Parikh SR, Borrow R, Kaczmarski E, Ramsay ME, Ladhani SN. Presentation with gastrointestinal symptoms and high case fatality associated with group W meningococcal disease (MenW (meningokokken groep W)) in teenagers, England, July 2015 to January 2016. Euro surveillance : bulletin Europeen sur les maladies transmissibles = European communicable disease bulletin. 2016;21(12).
- Moreno G, Lopez D, Vergara N, Gallegos D, Advis MF, Loayza S. [Clinical characterization of cases with meningococcal disease by W135 group in Chile, 2012]. Revista chilena de infectologia : organo oficial de la Sociedad Chilena de Infectologia. 2013;30(4):350-60.
- de Voer RM (risicomanagement), Mollema L, Schepp RM, de Greeff SC, van Gageldonk PG, de Melker HE, et al. Immunity against Neisseria meningitidis serogroup C in the Dutch population before and after introduction of the meningococcal c conjugate vaccine. PloS one. 2010;5(8):e12144.
- Pollard AJ, Green C, Sadarangani M, Snape MD. Adolescents need a booster of serogroup C meningococcal vaccine to protect them and maintain population control of the disease. Archives of disease in childhood. 2013;98(4):248-51.
- Christensen H, May M, Bowen L, Hickman M, Trotter CL. Meningococcal carriage by age: a systematic review and meta-analysis. The Lancet Infectious diseases. 2010;10(12):853-61.
- Stoof SP, van der Klis FR, van Rooijen DM, Knol MJ, Sanders EA, Berbers GA. Timing of an adolescent booster after single primary meningococcal serogroup C conjugate immunization at young age; an intervention study among Dutch teenagers. PloS one. 2014;9(6):e100651.
- van Ravenhorst MB (megabyte), Marinovic AB, van der Klis FR, van Rooijen DM, van Maurik M, Stoof SP, et al. Long-term persistence of protective antibodies in Dutch adolescents following a meningococcal serogroup C tetanus booster vaccination. Vaccine. 2016;34(50):6309-15.
- Ishola DA, Andrews N, Waight P, Yung CF (Cystic Fibrosis), Southern J, Bai X, et al. Randomized Trial to Compare the Immunogenicity and Safety of a CRM or TT Conjugated Quadrivalent Meningococcal Vaccine in Teenagers who Received a CRM or TT Conjugated Serogroup C Vaccine at Preschool Age. The Pediatric infectious disease journal. 2015;34(8):865-74.
- Agency EM. Bexsero [Available from: http://www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/human/medicines/002333/human_med_001614.jsp&mid=WC0b01ac058001d124.
- Ladhani SN, Ramsay M, Borrow R, Riordan A, Watson JM (Joint meeting), Pollard AJ. Enter B and W: two new meningococcal vaccine programmes launched. Archives of disease in childhood. 2016;101(1):91-5.