Wat in de volksmond griep genoemd wordt is een syndroom van luchtwegklachten, die in de epidemiologie aangeduid wordt als influenza-achtig ziektebeeld (IAZ (influenza-achtig ziektebeeld)). IAZ wordt veroorzaakt door infectie met influenzavirus, oftewel griepvirus, maar ook door andere soorten virussen. In de piek van de epidemie van IAZ in de winterperiode wordt IAZ meestal voor meer dan 70% veroorzaakt door een infectie met griepvirus, vandaar dat we spreken van griepepidemie. Het griepvaccin werkt alleen tegen infectie met griepvirus, en helpt de griepepidemie en de gevolgen daarvan, zoals ziekenhuisopname en oversterfte, te beperken. In het vervolg van dit artikel bedoelen we met griep de ziekte die veroorzaakt wordt door infectie met het griepvirus, en met virus bedoelen we griepvirus.
IB december 2016
Auteurs: A. Meijer, J. Timmermans, G. A. Donker, W. van der Hoek, G. F. Rimmelzwaan
Infectieziekten Bulletin, jaargang 27, nummer 10, december 2016
Tijdens elke griepepidemie is het weer spannend of het griepvaccin afdoende bescherming biedt tegen de virussen die deze epidemie veroorzaken. De reden waarom dit spannend is ligt in het feit dat voorspeld moet worden welke virussen in de komende winterperiode de griepepidemie kunnen gaan veroorzaken en dat er geschikte virussen gevonden moeten worden die als vaccinvirus kunnen dienen. Nadat de aanbevelingen voor de vaccinvirussen zijn gedaan duurt het nog ruim een half jaar voordat de vaccins in de koelkast van de huisarts en van zorginstellingen liggen. (1,2) Tijdens de lopende griepepidemie wordt nauwlettend in de gaten gehouden welke virussen de epidemie veroorzaken, of de virussen in het vaccin voldoende gelijkenis (antigene match) hebben met de epidemische virussen, wat de vaccineffectiviteit is en hoe de epidemie zich ontwikkelt. (2) Deze informatie is nodig om tijdig te kunnen reageren met aanvullende maatregelen, als er afwijkingen zijn van het normale patroon. Daarbij kan gedacht worden aan extra capaciteit bij huisartsen en in het ziekenhuis (onder andere op intensive care), en behandeling van ernstig zieken met antivirale middelen. De informatie is ook nodig om te zorgen voor gegevens voor het proces van selecteren en bepalen van de vaccinvirussen voor de volgende epidemie. Hoe dit gehele proces in zijn werk gaat, wordt beschreven in dit artikel.
Griepvaccin wordt elk jaar opnieuw geproduceerd
Griep bij mensen wordt veroorzaakt door 2 typen griep-virus, A en B. Het type A kent 18 hemagglutinine (H)- en 11 neuraminidase (N)subtypen die in allerlei combinaties bij vooral watervogels voorkomen. Sinds de pandemie in 2009 veroorzaken binnen type A de subtypen H1N1pdm09 en H3N2 griep bij mensen en binnen type B de evolutionaire lijnen B/Victoria/2/87 en B/Yamagata/16/88. Dit is wereldwijd zo, maar op het zuidelijk halfrond is dat in het midden van het kalenderjaar en op het noordelijk halfrond het einde van het ene jaar doorlopend in het begin van het daaropvolgende jaar; voor beide halfronden de winter-periode. In de tropen treedt griepactiviteit op als die ook op het noordelijk of het zuidelijk halfrond plaats vindt, dus eigenlijk het gehele jaar door. Elke winterperiode wordt de griepepidemie veroorzaakt door meestal minstens 1 van de A-subtypen en 1 van de B-lijnen. (3) Welke dat zullen zijn is nauwelijks te voorspellen en daarom worden er 3 virussen opgenomen in het trivalente griepvaccin (A(H1N1)pdm09, A(H3N2) en 1 van de B-lijnen) en 4 in het quadrivalente griepvaccin (beide A subtypen en beide B-lijnen).
Er bestaat geen kruisbescherming tussen A(H1N1)pdm09 en A(H3N2). Tot in het eerste decennium van de 21e eeuw was er voldoende kruisbescherming tussen beide B-lijnen. Gradueel nam dat af totdat een aantal jaren geleden kruisbescherming onvoldoende was geworden en het belangrijker werd om de juiste B-lijn in het trivalente vaccin op te nemen. Omdat regelmatig een andere B-lijn, dan die is opgenomen in het trivalente vaccin, epidemisch gaat circuleren (3), heeft de World Health Organization (WHO (World Health Organization)) in samenspraak met de vaccinfabrikanten besloten dat er een quadrivalent vaccin op de markt gebracht moest worden waarin beide B-lijnen zijn opgenomen. Sinds een aantal jaren zijn die vaccins op de markt, maar worden nog niet breed gebruikt in de wereld. Waar ze geregistreerd zijn en in nationale programma’s aangeraden worden, is dat vooral voor jonge kinderen, omdat influenza B vaker kinderen treft dan volwassenen en de kans groot is dat jonge kinderen nog nooit eerder in hun leven in aanraking zijn geweest met een influenza B-virus. In Nederland heeft de Gezondheidsraad (GR (groepsrisico)) in haar advies aangegeven geen reden te zien om gezonde kinderen toe te voegen aan de doelgroepen voor griepvaccinatie. (4) In Nederland is trivalent vaccin opgenomen in het Nationaal Programma Grieppreventie.
Elk jaar wordt door de WHO in februari en september, voor respectievelijk het noordelijk en het zuidelijk halfrond, de vaccinsamenstelling opnieuw bekeken. (1, 2) Dit is nodig omdat griepvirus de eigenschap heeft om relatief snel aan bestaande immuniteit te ontsnappen, ook wel antigene drift genoemd. Immuniteit door antistoffen die opgewekt wordt door infectie of vaccinatie is vooral gericht tegen het hemagglutinine van type A- en B-virussen. Hoewel T-cellen een rol spelen in immuniteit tegen infectie met griepvirus, wordt de T-celrespons nog niet gebruikt om het resultaat van vaccinatie te meten, ook niet in de vernieuwde richtlijn van de European Medicines Agency (EMA (European Medicines Agency)). (5)
Vaccinatie biedt circa een half tot 1 jaar bescherming, natuurlijke infectie langer. (6-8) Omdat griepvirus slordig is in het kopiëren van haar eigen erfelijk materiaal, kunnen er relatief gemakkelijk virusvarianten ontstaan die in zekere mate aan de immuniteit ontsnappen en zich verspreiden. Van een vaccinmismatch spreken we als voor 1 of meer van de virussen in het vaccin, de opgewekte immuniteit onvoldoende is om optimale bescherming te bieden tegen de circulerende virussen. Door wetenschappelijk gebaseerde voorspelling van de virussen die de volgende epidemie zouden kunnen veroorzaken wordt getracht vaccinmismatch te voorkomen, maar dit blijkt soms lastig te zijn. (9)
Meten van griepvaccinmatch
Een eerste maat voor vaccinmatch is hoe goed het hemagglutinine van de griepvaccinvirussen en van de circulerende griepvirussen, wat antigene eigenschappen betreft, op elkaar lijken. Dit wordt gemeten met de hemagglutinatie-remmingsreactie (HAR (hemagglutinatie-remmingsreactie)) door antistoffen die in fretten zijn opgewekt tegen de vaccinvirussen, te laten reageren in de aanwezigheid van rode bloedcellen met deze vaccinvirussen en met de griepvirussen die bij patiënten zijn gevonden. Griepvirussen hebben namelijk de eigenschap om rode bloedcellen te laten klonteren door binding van het hemagglutinine van het griepvirus aan de rode bloedcellen; dit heet hemagglutinatie. Antistoffen tegen het hemagglutinine kunnen deze klontering remmen. Door de hoeveelheid frettenantistoffen te bepalen die nodig is om hemagglutinatie van een gestandaardiseerde hoeveelheid virus volledig te voorkomen – de hemagglutinatieremmingstiter – voor zowel het vaccinvirus als het circulerende virus, wordt een indicatie van de antigene gelijkenis van beide virussen verkregen. Is het verschil in hemagglutinatieremmingstiter tussen vaccinvirus en circulerend virus groter dan 4-voudig, dan spreken we van een antigene mismatch.
Een tweede maat voor vaccinmatch is de reactiviteit van sera van mensen die gevaccineerd zijn, met de circulerende virussen. Dit wordt ook gemeten met de HAR.
Een derde maat voor vaccinmatch is de vaccineffectiviteit, die gemeten wordt als het percentage reductie in griepvirusinfecties in gevaccineerde patiënten in vergelijking met ongevaccineerde patiënten. Deze maat is alleen betrouwbaar bij grote aantallen laboratoriumdiagnoses bij gevaccineerde en niet gevaccineerde patiënten. Daarom worden hiervoor gegevens uit meerdere landen in Europa gecombineerd. (10) In 2015 zijn de Europese criteria voor evaluatie van griepvaccins gewijzigd. In plaats van toetsing op basis van serologische drempelwaarden, eist het EMA nu dat klinische werkzaamheid van het vaccin, dus vaccineffectiviteit wordt aangetoond. (5)
Selectie van griepvirussen voor opname in het griepvaccin
Om te weten welke griepvirussen wereldwijd rondgaan en epidemieën veroorzaken en aan de hand daarvan aanbevelingen te kunnen doen voor de vaccinsamenstelling, heeft de WHO in 1947 een wereldwijd netwerk van Collaborating Centres for influenza (WHO CCs) en National Influenza Centres (NICs) in het leven geroepen; dit netwerk heet nu het Global Influenza Surveillance and Response System (GISRS). De NICs voeren in hun land het hele jaar door de griepsurveillance uit en verzamelen virussen en belangrijke patiëntinformatie die ze naar de WHO CCs doorsturen. In Nederland vormen het Rijksinstituut voor Volksgezondheid en het Milieu (RIVM) in Bilthoven en het Erasmus Medisch Centrum (ErasmusMC (Erasmus Medical Center)) in Rotterdam het Nederlandse NIC (Nationaal Influenza Centrum) dat, in samenwerking met het Nederlands instituut voor onderzoek van de gezondheidszorg (NIVEL (Nederlands instituut voor onderzoek van de gezondheidszorg)) in Utrecht en met diagnostische laboratoria in Nederland, de griep in Nederland monitort. (3)
De WHO CCs maken een uitgebreide karakterisering van de griepvirussen en combineren die data wereldwijd om in februari (voor het noordelijk halfrond) en september (voor het zuidelijk halfrond) de discussie te voeren over de aanbevelingen voor de griepvaccinsamenstelling. Hiervoor doen zij ook proefvaccinaties in mensen om te zien of de door het griepvaccin opgewekte antistoffen voldoende goed met de circulerende griepvirussen reageren. De meeste griepvaccins zijn geregistreerd met vaccinvirussen die in bebroede kippeneieren zijn gekweekt, en mogen daarom ook alleen gemaakt worden met virussen die in eieren uit klinisch materiaal zijn geïsoleerd en vermeerderd. Dit stamt uit de tijd dat er nog geen celkweek bestond, en wordt nog steeds gepraktiseerd omdat bij kweek in eieren op eenvoudige wijze een grote hoeveelheid virus geproduceerd kan worden. Voor B-type vaccinvirussen worden virussen gebruikt die uit klinisch materiaal in eieren zijn geïsoleerd en van zichzelf snel en in grote hoeveelheden in eieren vermeerderen. De reassortant A-type vaccinvirussen worden in eieren gemaakt door een proces van hersorteren van de HA- en NA-genoomsegmenten van kandidaat-vaccinvirus met de overige 6 genoomsegmenten van een standaard virus (A/Puerto Rico/8/34) dat snel en in grote hoeveelheden in eieren vermeerdert. Vaak moet een WHO CCs een mogelijk vaccinvirus opnieuw uit klinisch materiaal in ei isoleren, omdat de meeste NICs celkweek gebruiken voor virusisolatie en de WHO CCs deze virussen niet mogen gebruiken voor het maken van kandidaat-vaccinvirussen. Omdat de moleculen waaraan het virus bindt op cellen bij vogels verschillen van die bij mensen, kan door kweek in eieren het menselijke virus veranderingen ondergaan, waardoor het antigeen niet meer optimaal aansluit bij circulerende virussen. Hoewel de verandering van antigene eigenschappen veroorzaakt door kweek in eieren kan worden voorkomen door het vermeerderen van vaccinvirus in celkweek, zijn er slechts enkele vaccins op de markt die geregistreerd zijn met virussen die in cellen zijn geïsoleerd en vermeerderd, in plaats van in eieren. De reden daarvoor is dat de productie van de gewenste hoeveelheid virus in cellen voor vaccinproducenten dusdanig complex blijkt te zijn, dat verschillende producenten zelfs al gestopt zijn hierin verder te investeren.
De vaccinvirussen worden door de WHO CCs in samenwerking met National Regulatory Laboratories in Australië, de Verenigde Staten en Groot-Brittannië en enkele contractlaboratoria voor hoog-gespecialiseerd werk, gemaakt en uitgebreid geëvalueerd. Samen met de griepvaccinproducenten wordt er elk jaar voor gezorgd dat er voldoende griepvaccin van de juiste samenstelling beschikbaar is voor de start van de griepvaccinatie campagnes.
Stappen die doorlopen worden in het productieproces van het griepvaccin
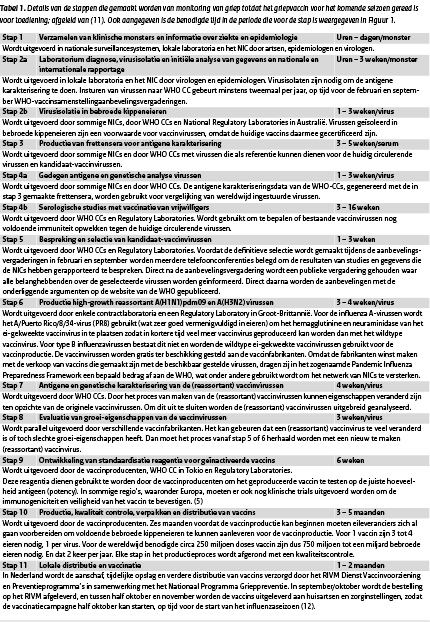
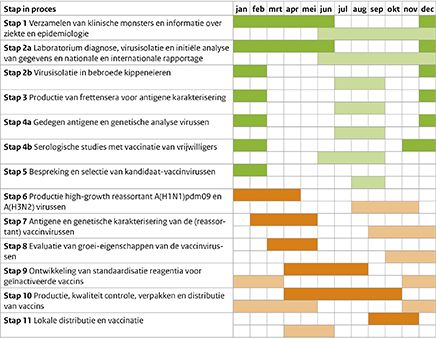
De benodigde tijd vanaf het moment dat bekend is welke virussen er in het griepvaccin moeten komen tot het moment waarop het vaccin in de koelkast bij de huisarts en zorginstellingen ligt, is 7 tot 8 maanden. Het tijdspad van de voorbereidende stappen en de stappen in het productieproces van het griepvaccin, staat met gedetailleerde toelichting weergegeven in Figuur 1 en Tabel 1.
Tabel 1 Details van de stappen die gemaakt worden van monitoring van griep totdat het griepvaccin voor het komende seizoen gereed is voor toediening; afgeleid van (11). Ook aangegeven is de benodigde tijd in de periode die voor de stap is weergegeven in Figuur 1 (Download de pdf voor een vergrote weergave, pag 297).
Figuur 1 Tijdlijn van de stappen die gemaakt worden van monitoring van griep totdat het griepvaccin voor het komende seizoen gereed is voor toediening; afgeleid van (11). *In stap 1 tot en met 5 geven de groene balken de periodes weer waarin de voorbereidende monitoringsactiviteiten en de selectie van kandidaat-vaccinvirussen zich concentreren. *In stap 6 tot en met 11 geven de oranje balken de periodes weer in het productieproces van het vaccin zelf. *In de tijdlijn is zowel het proces voor het noordelijk halfrond (donkere balken; vaccinvirusselectie in februari) als het zuidelijk halfrond (lichte balken; vaccinvirusselectie in september) weergegeven.
*Details van de stappen staan in Tabel 1. (Download de pdf voor een vergrote weergave, pagina 296).
Ondanks alle zorg die wordt besteed aan de selectie van vaccinvirussen kan de match van 1 of meer van de vaccincomponenten met de griepvirussen die de epidemie veroorzaken, suboptimaal zijn. Daar zijn een viertal redenen voor te noemen:
- Ruim een half jaar van te voren kan nooit helemaal met zekerheid voorspeld worden welke virustypen, A-subtypen en B-lijnen in de komende seizoensepidemie dominant gaan circuleren en of de antigene eigenschappen van die griepvirussen nog steeds hetzelfde zullen zijn. Tijdens de seizoensepidemie op het andere wereldhalfrond en tijdens de min of meer continue circulatie van griepvirussen in de tropen kunnen er antigene veranderingen in griepvirussen ontstaan (antigene drift), waardoor de match vanaf het begin van de epidemie op het andere halfrond suboptimaal is.
- Tijdens de epidemie op het eigen wereldhalfrond, of in eigen land, kunnen er ook antigene veranderingen in het griepvirus optreden waardoor de vaccinmatch gedurende het seizoen suboptimaal kan worden. Het is dan afhankelijk van de timing van de start van de epidemie in Nederland ten opzichte van wanneer en waar die antigene verandering is opgetreden, hoe groot dit effect is voor Nederland.
- Soms is het niet gelukt om het meest optimale vaccin-virus te verkrijgen, omdat daarvan geen uit ei geïsoleerd virus beschikbaar was, of omdat door kweek in eieren er antigene veranderingen in een vaccinvirus zijn opgetreden, waardoor de match suboptimaal is geworden en er geen tijd meer was om nieuw vaccinvirus te maken.
Bij een trivalent griepvaccin kan het gebeuren, dat er een andere lijn van het B-type influenzavirus dan de lijn die in het griepvaccin is opgenomen, dominant wordt tijdens de epidemie. Recent was dat in Nederland het geval tijdens de 2015/2016 griepepidemie. Toen circuleerde vooral griepvirus B van de Victoria-lijn in de bevolking, maar in het trivalente griepvaccin was alleen het griep-virus B van de Yamagata-lijn opgenomen. Bij quadrivalent griepvaccin treedt dit probleem niet op.
Is de mismatch door antigene drift groot, dan zijn, als de epidemie al in gang is, antivirale middelen de enige optie voor profylaxe en behandeling van ernstig zieke patiënten en patiënten met een hoog risico op complicaties bij griepvirusinfecties waar vaccinatie faalt. Een voorbeeld hiervan is het opduiken van de zogenoemde Fujianvariant van het A(H3N2)-griepvirus in 2003/2004. Toen was een passend vaccinvirus niet voorhanden en werd de nationale voorraad antiviraal middel Tamiflu aangesproken, voor behandeling van grieppatiënten en postexpositieprofylaxe in verpleeg- en verzorgingshuizen. (13, 14) Het beleid in Nederland voor brede toepassing van antivirale middelen is echter terughoudend. (15) Een echt grote antigene mismatch treedt op als er een voor mensen compleet nieuw griepvirus onder mensen gaat circuleren, meestal door overdracht uit dieren. Vanwege de grote verandering heet dat dan een antigene shift in plaats van antigene drift. Als dit gebeurt en het nieuwe griepvirus zich efficiënt van mens-naar-mens verspreidt, kan dit tot een uitbraak, een epidemie of in zeldzame gevallen een pandemie leiden. Hiervoor moet dan een compleet nieuw vaccin gemaakt worden. Het meest recente voorbeeld hiervan is de grieppandemie van 2009, die werd veroorzaakt door A(H1N1)pdm09 griepvirus afkomstig uit varkens en waarvan het epicentrum Mexico was. (16)
Auteurs
A. Meijer1, J. Timmermans1, G. A. Donker2, W. van der Hoek1, G. F. Rimmelzwaan3
- Centrum Infectieziektebestrijding, RIVM, Bilthoven
- NIVEL, Nationaal instituut voor onderzoek van de gezondheidszorg, Utrecht
- fdeling Viroscience, Erasmus Medisch Centrum, Rotterdam
Correspondentie
Wij bedanken de International Federation of Pharmaceutical Manufacturers & Associations (IFPMA) voor verkrijgen van inzicht in de stappen, en de timing van die stappen, van het productieproces van het griepvaccin.
- Gerdil C. The annual production cycle for influenza vaccine. Vaccine. 2003; 21: 1776-1779.
- Stöhr K, Bucher D, Colgate T, Wood J. Influenza virus surveillance, vaccine strain selection, and manufacture. Methods Mol Biol. 2012; 865: 147-162.
- Meijer A, Rimmelzwaan GF, Dijkstra F, Donker GA. Actuele ontwikkelingen betreffende influenza; griepspotters in actie. Tijdschr Infect 2009; 4: 176-184.
- Gezondheidsraad. Briefadvies Vaccinatie tegen seizoensgriep. Den Haag: Gezondheidsraad, 2011; publicatienr. 2011/21. Beschikbaar van: https://www.gezondheidsraad.nl/nl/taak-werkwijze/werkterrein/preventie/…. Geraadpleegd 14 september 2016.
- European Medicines Agency (2016). Guideline on influenza vaccines: non-clinical and clinical module. EMA (European Medicines Agency), Committee for medicinal products for human use, report EMA/CHMP/VWP/457259/2014, London, UK (United Kingdom).
- Radin JM (Joint meeting), Hawksworth AW, Myers CA, Ricketts MN, Hansen EA, Brice GT. Influenza vaccine effectiveness: Maintained protection throughout the duration of influenza seasons 2010-2011 through 2013-2014. Vaccine. 2016; 34 :3907-3912.
- Mohn KG, Bredholt G, Brokstad KA, et al. Longevity of B-cell and T-cell responses after live attenuated influenza vaccination in children. J Infect Dis. 2015; 211: 1541-1549.
- Delabre RM (risicomanagement), Salez N, Lemaitre M, Leruez-Ville M, de Lamballerie X, Carrat F. Antibody persistence and serological protection among seasonal 2007 influenza A(H1N1) infected subjects: Results from the FLUREC cohort study. Vaccine. 2015; 33: 7015-7021.
- Neher RA, Bedford T, Daniels RS (respiratoir syncytieel), Russell CA, Shraiman BI. Prediction, dynamics, and visualization of antigenic phenotypes of seasonal influenza viruses. Proc Natl Acad Sci U S A. 2016; 113: E1701-1709.
- Kissling E, Nunes B, Robertson C, et al. I-MOVE multicenter case-control study 2010/11 to 2014/15: Is there within-season waning of influenza type/subtype vaccine effectiveness with increasing time since vaccination? Euro Surveill. 2016; 21: pii=30201.
- A description of the process of seasonal and H5N1 influenza vaccine virus selection and development. World Health Organisation, draft 19 November 2007. Beschikbaar van: http://www.who.int/influenza/resources/documents/influenza_vaccine-viru… Geraadpleegd 3 augustus 2016.
- Donker G, Gravestein J. De beste tijd voor griepvaccinatie. Huisarts & Wetenschap. 2007; 50: 41.
- Makizumi K, Kimachi K, Fukada K, et al. Timely production of A/Fujian-like influenza vaccine matching the 2003-2004 epidemic strain may have been possible using Madin-Darby canine kidney cells. Vaccine. 2008; 26: 6852-6858.
- van Gageldonk-Lafeber AB, van der Sande MAB, van Vliet JA et al. Surveillance van het verloop van influenza-uitbraken en oseltamivir gebruik in verpleeg- en verzorgingshuizen in Nederland. Rapportage over influenzaseizoen 2003/2004. RIVM rapport 217617007/2006. Beschikbaar van: http://rivm.openrepository.com/rivm/bitstream/10029/7232/1/217617007.pdf. Geraadpleegd: 14 september 2016.
- LCI (Landelijke coördinatie infectieziektebestrijding)-richtlijn Influenza. Rijksinstituut voor de volksgezondheid en het milieu, 5 mei 2011. Beschikbaar van: http://www.rivm.nl/Documenten_en_publicaties/Professioneel_Praktisch/Ri…. Geraadpleegd 3 augustus 2016.
- Koopmans MP, Meijer A, van der Lubben MI (myocardial infarctions), et al. Bestrijding van de nieuwe influenza A (H1N1). I. – Overzicht van de relevant virologische aspecten. Ned Tijdschr Geneeskd. 2009; 153: A770.