Psittacose is een ondergediagnosticeerde oorzaak van pneumonie. In Nederland wordt de diagnose vooral gesteld op basis van serologisch onderzoek, waarbij 2 sera met een tussentijd van 2-3 weken onderzocht moeten worden. Een veel snellere diagnose is mogelijk door het aantonen van Chlamydia psittaci in lichaamsmateriaal met behulp van een polymerasekettingreactie (PCR (polymerase chain reaction)). Genotypering van PCR-positieve monsters maakt het mogelijk een vergelijking te maken met monsters afkomstig van vogels. Recente uitbraken van psittacose hebben aangetoond dat resultaten van serologisch onderzoek, vooral als slechts één serum beschikbaar is, moeilijk te interpreteren zijn. Voor populatiestudies, bijvoorbeeld naar de mogelijke rol van pluimvee als bron van psittacose, is het noodzakelijk over een serologische test te beschikken die specifiek is voor C. psittaci (chlamydia psittaci) en niet kruisreageert met andere Chlamydia-bacteriën.
ib februari 2014
Auteurs: W. van der Hoek, A.B. van Gageldonk-Lafeber, E.R. Heddema, D.W. Notermans, J.W. Den Boer, A. Nieuwenhuizen, A.M.L. Tjon-A-Tsien, F. Dijkstra, A. Meijer
Infectieziekten Bulletin, jaargang 25, nummer 2, februari 2014
Psittacose (papegaaienziekte) is een infectieziekte die overgedragen kan worden van vogels naar de mens door inademen van stofdeeltjes die besmet zijn met de bacterie Chlamydia psittaci. Psittacose is bij zowel de mens als bij vogels meldingsplichtig. Het gemiddeld aantal humane meldingen in het Nederlandse meldingssysteem Osiris over de afgelopen 10 jaar was 62 per jaar (spreiding 26-83). Het kleine aantal meldingen suggereert dat psittacose geen belangrijk volksgezondheidsprobleem is. Toch zijn er diverse redenen om de problematiek rond psittacose nog eens onder de aandacht te brengen:
- Zoals bij veel infectieziekten is het aantal meldingen een grote onderschatting van het werkelijk aantal patiënten. De klinische presentatie van psittacose is aspecifiek en is meestal een griepachtig beeld met koorts of een pneumonie. In de huisartsenpraktijk wordt bij een dergelijk klinisch beeld over het algemeen geen microbiologisch laboratoriumonderzoek verricht, zodat de oorzaak van het ziektebeeld onbekend blijft. Ook als er wel laboratoriumonderzoek gedaan wordt is C. psittaci (chlamydia psittaci) niet altijd deel van het pakket. Onderzoeken naar de etiologie van thuis opgelopen pneumonie (community-acquired pneumonia, CAP) suggereren dat in Nederland 1-5% van de opnames in het ziekenhuis wegens CAP, veroorzaakt wordt door C. psittaci. (1-3) Omdat in Nederland per jaar ongeveer 30.000 patiënten met CAP in het ziekenhuis worden opgenomen zou het werkelijke aantal ernstige psittacosepneumonieën dan tussen de 300 en 1.500 per jaar kunnen liggen. (4)
- Er hebben zich in Nederland diverse uitbraken van psittacose voorgedaan waarbij het moeilijk bleek de resultaten van serologisch onderzoek te interpreteren. De belangrijkste recente voorbeelden zijn de uitbraken onder bezoekers van een vogelshow in Weurt in 2007 en een onder medewerkers van een vogelopvang in Rotterdam in 2012. (5,6)
- In een onderzoek naar de mogelijke gezondheidseffecten van intensieve veehouderij werd een verhoogde incidentie van pneumonie aangetoond rond geitenbedrijven en rond pluimveebedrijven. (7) Omdat dit onderzoek in 2009 is uitgevoerd, het piekjaar van de Nederlandse Q-koortsepidemie, kon de verhoogde incidentie rond geitenbedrijven aan Q-koorts worden toegeschreven. Er was echter geen verklaring voor de verhoogde incidentie rond pluimveebedrijven. Het is belangrijk de mogelijke rol van psittacose als oorzaak van deze onverklaarde pneumonieën nader te onderzoeken, omdat studies in onder andere België hebben aangetoond dat psittacose niet alleen door papegaai-achtigen maar ook door pluimvee op de mens kan worden overgedragen. (8) In 2013 startte het onderzoek Veehouderij en Gezondheid Omwonenden (VGO (Livestock farming and the health of local residents)), waarbij onder 3.000 inwoners van oostelijk Brabant en noordelijk Limburg serologisch onderzoek zal worden verricht en waarbij ook in de lucht wordt gezocht naar C. psittaci.
In dit artikel gaan wij in op de beperkingen van de huidige laboratoriumdiagnostiek bij de mens en de noodzaak om serologische methoden te ontwikkelen die ook geschikt zijn voor epidemiologisch onderzoek.
Laboratoriumdiagnostiek en meldingscriteria
Omdat C. psittaci intracellulair groeit, kan de bacterie niet met de routine bacteriologische kweken op voedingsbodems gekweekt worden. Diagnostiek voor psittacose moet daarom gedaan worden door detectie van antistoffen in het serum of met de PCR (polymerase chain reaction) (polymerase chain reaction) of andere nucleïnezuuramplificatietechnieken.
Er bestaan diverse serologische technieken om psittacose vast te stellen. Vanouds wordt de complementbindingsreactie (CBR (complementbindingsreactie)) het meest gebruikt. Deze test detecteert antistoffen tegen het lipopolysacharide (LPS) antigeen van de Chlamydia-bacterie in het serum van een patiënt. Dit LPS komt echter voor bij alle Chlamydia-soorten waardoor de CBR geen onderscheid kan maken tussen infectie veroorzaakt door C. psittaci, C. trachomatis, C. abortus (chlamydia-abortus) en C. pneumoniae. Dit geldt in wat meer of mindere mate ook voor de meer recent ontwikkelde technieken zoals de ELISA (Enzyme-Linked Immunosorbent assay)- (enzyme-linked immunosorbent assay) en de MIF- (micro-immunofluorescentie)test. Het ontwikkelen van een detecteerbare antistofrespons kan enkele weken duren, zodat een negatieve test tijdens de acute klachten psittacose niet uitsluit. Voor goede serologische diagnostiek zijn dus gepaarde sera nodig, terwijl in de dagelijkse praktijk een tweede monster vaak niet wordt afgenomen, vooral niet als de patiënt intussen is opgeknapt.
Met PCR is een veel snellere en specifiekere diagnose mogelijk, zodat tijdig een gerichte antibiotische behandeling kan worden ingesteld. Een in Nederland veel gebruikte PCR kan C. psittaci detecteren en onderscheiden van C. trachomatis en C. pneumoniae, maar niet van nauwer verwante species zoals C. abortus of C. caviae. (9, 10) Wel is het vaak moeilijk om goed klinisch materiaal uit de diepere luchtwegen (sputum of eventueel bronchoalveolaire lavagevloeistof) te verkrijgen voor PCR-onderzoek, omdat meestal sprake is van een niet-productieve hoest. Met gemakkelijker af te nemen materiaal uit de bovenste luchtwegen, een keel/nasopharynx uitstrijk, heeft de PCR echter een aanzienlijk lagere sensitiviteit. In tegenstelling tot serologie heeft de PCR de meeste opbrengst vroeg in het ziektebeeld.
De huidige meldingscriteria voor psittacose zijn:
- een patiënt met een PCR positief voor C. psittaci-DNA (deoxyribonucleic acid) van een respiratoir monster, bloed, serum of plasma, of
- een patiënt met een passend klinisch ziektebeeld in combinatie met een viervoudige titerstijging. Dit dient vastgesteld te zijn met behulp van CBR of MIF in een acuut en convalescent serummonster of met ELISA waarbij een verdubbeling van de IgM (immuunglobuline M) òf een verdrievoudiging van de IgG (Immunoglobulin G) òf een verdubbeling van de IgA (Immunoglobuline A) in combinatie met een verdubbeling van de IgG aangetoond is (http://www.rivm.nl/Documenten_en_publicaties/Professioneel_Praktisch/Richtlijnen/Infectieziekten/LCI_richtlijnen/LCI_richtlijn_Psittacose, geraadpleegd op 23 oktober 2013).
De meldingscriteria geven geen specificatie van de antigenen en de specificiteit van de te gebruiken MIF en ELISA. Dit is onderdeel van de problematiek bij de interpretatie van uitslagen van deze testen. Onder andere omdat zowel C. pneumoniae als C. psittaci in beginsel vergelijkbare respiratoire klachten kunnen geven. Indien slechts 1 serummonster beschikbaar is kan niet aan de meldingscriteria worden voldaan ook al is volgens de behandelende arts op basis van ziektegeschiedenis, klinisch beeld en éénmalig hoge titer vrijwel zeker sprake van de diagnose psittacose.
Naast het voordeel voor de individuele patiënt, heeft klinische diagnostiek op basis van PCR ook vanuit het oogpunt van de publieke gezondheid de voorkeur. PCR biedt immers de mogelijkheid om de isolaten genetisch te typeren, wat een vergelijking mogelijk maakt met isolaten die bij vogels worden gevonden waarmee de patiënten in contact zijn geweest. Een dergelijke genotypische match maakt het voor GGD (Gemeentelijke Gezondheidsdienst) en de Nederlandse Voedsel- en Warenautoriteit (NVWA (Nederlandse Voedsel- en Warenautoriteit)) mogelijk de bron op te sporen en gericht bestrijdingsmaatregelen te nemen. Voor de individuele patiënt is het genotyperen van PCR-positieve humane monsters echter niet van belang voor behandeling. Daarom bestaat er de mogelijkheid om ten laste van het diagnostiekbudget van de Openbare Gezondheidszorg (OGZ (openbare gezondheidszorg)), PCR-positieve monsters te laten genotyperen in het Orbis Medisch Centrum in Sittard. Dat gebeurt door middel van het sequencen van het OmpA-gen. (11) Genotypering van monsters afkomstig van vogels op verzoek van de NVWA gebeurt bij het Centraal Veterinair Instituut (CVI (Central Veterinary Institute), http://www.wageningenur.nl/nl/show/papegaaienziekte.htm, geraadpleegd op 18 oktober 2013). Het harmoniseren en integreren van humane en veterinaire typeringen is onderwerp van een projectvoorstel van CVI, RIVM en andere partners, waarvoor nog financiering wordt gezocht.
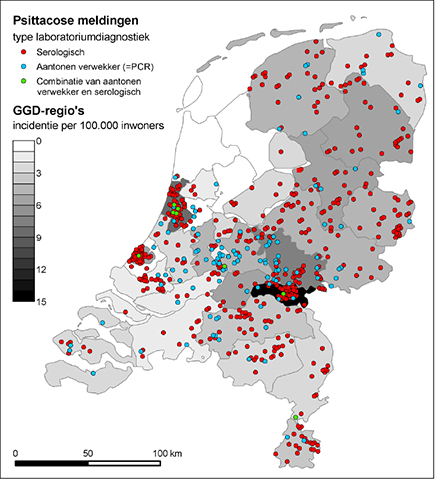
Er zijn in Nederland aanzienlijke regionale verschillen in de methoden van klinische laboratoriumdiagnostiek en ook in de incidentie van psittacosemeldingen. Zo blijkt PCR-diagnostiek vooral uitgevoerd te worden in het midden van het land en is in de kop van Noord-Holland door onduidelijke oorzaak sprake van een opvallend lage incidentie. (Figuur 1)
Figuur 1 Incidentie van psittacosemeldingen per GGD-regio over de periode 1 januari 2004 tot en met 3 oktober 2013 en laboratoriummethodes die gebruikt zijn om de diagnose psittacose te stellen (n = 591)
Sero-epidemiologisch onderzoek
Voor surveillance en onderzoek naar het voorkomen van psittacose bij gezonde mensen in de algemene bevolking of na blootstelling aan een bekende bron, is serologische diagnostiek aangewezen. Bij surveillance en ook onderzoek naar risicofactoren van infectie met C. psittaci bij een blootgestelde populatie zoals tijdens een uitbraak of in het kader van het VGO-project, zal veelal gebruik gemaakt worden van éénmalig serologisch onderzoek. Dat kan problematisch zijn omdat de beschikbare serologische testen een (zeer) lage specificiteit hebben, dat wil zeggen dat er veel fout-positieve resultaten kunnen zijn. Het belangrijkste probleem is kruisreactiviteit met C. pneumoniae, waarvan de prevalentie onder de algemene bevolking boven de 50% kan liggen. De hieronder beschreven 2 grootste recente uitbraken van psittacose tonen de problemen in de praktijk.
Uitbraak na een vogelshow in Weurt, 2007
Na een vogelshow in Weurt in november 2007, werd bij een aantal van de ongeveer 200 bezoekers psittacose vastgesteld. Tenminste 25 mensen zijn binnen 2 weken na het bezoek aan de vogelshow ziek geworden, van wie een aantal opgenomen werd in het ziekenhuis. (5) Door middel van PCR- onderzoek kon bij enkele patiënten snel de diagnose C. psittaci-infectie worden gesteld. (6) Om inzicht te krijgen in het percentage bezoekers dat geïnfecteerd raakte (attack rate) en in risicofactoren voor infectie werd bij 156 bezoekers serologisch onderzoek verricht. In de meeste gevallen werd dit tweemaal met een tussenpoos van 2 weken gedaan en werd een vragenlijst afgenomen. Op basis van aanwezigheid van IgM- en IgG-antistoffen in een chlamydiaspeciesbrede ELISA-test gekoppeld aan blootstelling, werd aanvankelijk gerapporteerd dat 42 (27%) van de bezoekers vermoedelijk een recente infectie met C. psittaci hadden doorgemaakt en 75 (48%) in het verleden een infectie hadden doorgemaakt met Chlamydia. Echter, bij geen enkele deelnemer werd een titerstijging vastgesteld die noodzakelijk is om een recente infectie vast te kunnen stellen. In een panel van 25 enkelvoudige sera van gezonde vrijwilligers bleek 30% een IgM-respons te hebben in dezelfde chlamydiaspeciesspecifieke ELISA. Dit maakt de aanvankelijk gerapporteerde hoge attack rate twijfelachtig en maakt een risicofactoranalyse vrijwel onmogelijk. Aangenomen moet worden dat een aanzienlijk deel van de personen C. pneumoniae- of een andere Chlamydia-infectie heeft doorgemaakt omdat antistoffen tegen deze bacteriën ook gedetecteerd worden in de gebruikte ELISA met brede Chlamydiaspecificiteit.
Uitbraak onder medewerkers van een vogelopvang in Rotterdam, 2012
Eind mei 2012 werd een vrijwilliger van een vogelopvang in Rotterdam in het ziekenhuis opgenomen met een pneumonie. In de eerste week van juni 2012 werden meerdere vrijwilligers en 1 bezoeker ziek. Uiteindelijk hebben 40 personen klachten gerapporteerd, van wie er 23 voldeden aan de klinische casusdefinitie opgesteld door de GGD. De eerste ziektedag lag tussen 21 mei en 14 augustus. Bij 6 personen werd een infectie met C. psittaci bevestigd door een viervoudige titerstijging en 2 personen hadden een positieve PCR. Bij de vogelopvang worden jaarlijks 8.000 vogels opgevangen. Er werken ruim 100 vrijwilligers en 3 vaste medewerkers. Deze mensen hebben intensief contact met de vogels tijdens hun verzorging, onder andere bij het voeden en het dagelijks verschonen van de hokken. De GGD Rotterdam startte, samen met het RIVM, een onderzoek onder alle medewerkers van de vogelopvang. Via een vragenlijst zijn gezondheidsklachten en het soort en de mate van vogelcontact geïnventariseerd om mogelijk risicovolle handelingen met vogels te kunnen identificeren. Interpretatie van de serologische onderzoeksresultaten van patiënten is echter moeilijk omdat slechts van een deel van de patiënten serologiemonsters beschikbaar is. Daarnaast zijn deze serologische onderzoeksresultaten niet goed te interpreteren zonder die van de vrijwilligers en medewerkers die niet ziek zijn geworden en een controlegroep die niet blootgesteld is geweest. Ook zou net als bij de uitbraak in Weurt ook hier weer het probleem kunnen spelen van kruisreactiviteit, omdat er geen C. psittaci-specifieke serologische test beschikbaar is en net als bij de uitbraak in Weurt teruggevallen moet worden op meer generieke detectie van antilichamen tegen Chlamydia.
Beschouwing
Een belangrijk aandachtspunt bij psittacose is het bevorderen van vroegtijdig PCR-onderzoek voor snelle en specifieke diagnose ten bate van de behandeling van de individuele patiënt en bij uitbraken. Bij een uitbraak onder diergeneeskundestudenten en docenten in 2004 kon de bron worden opgespoord met behulp van real-time PCR en genotypering van humane - en vogelisolaten en konden passende maatregelen worden genomen. (11) Bij patiënten met CAP zou vaker PCR-diagnostiek naar psittacose moeten worden verricht als er contact is geweest met vogels. Onderdiagnostiek van psittacose is echter niet iets dat op korte termijn sterk zal verminderen. De huidige richtlijn Acuut Hoesten van het Nederlands Huisartsen Genootschap (NHG (Nederlands Huisartsen Genootschap)) geeft aan dat het merendeel van de pneumoniepatiënten op basis van klinische presentatie kan worden gediagnostiseerd en behandeld, dus zonder medisch microbiologisch onderzoek (https://www.nhg.org/standaarden/volledig/nhg-standaard-acuut-hoesten, geraadpleegd op 4 september 2013). Richtlijnen in andere landen, bijvoorbeeld de Verenigde Staten hebben veelal dezelfde strekking. (12) Onderzoek in Nederland laat zien dat 95% van de patiënten met pneumonie succesvol door de huisarts wordt behandeld. (13) Toch is het zo dat bij de zogenoemde ‘atypische pneumonie’ zoals veroorzaakt door C. psittaci, Coxiella burnetii en Legionella pneumophila, een behandeling met andere antibiotica noodzakelijk is dan met amoxicilline, wat in de NHG-standaard als eerste keus wordt aanbevolen, omdat de genoemde bacteriën daarvoor ongevoelig zijn. Als betere, snellere en goedkopere testen beschikbaar komen lijkt het daarom toch van belang de discussie aan te gaan over mogelijke verbeteringen in de diagnostiek bij CAP. Een probleem blijft dan nog wel dat psittacose meestal gepaard gaat met droge, onproductieve hoest en het uitvoeren van een broncho-alveolaire lavage (BAL) zal voor patiënt en arts vaak een stap te ver zijn.
Met de huidige state-of-the-art-serologie kan de diagnose psittacose bij de individuele patiënt ook op basis van serologisch onderzoek worden gesteld als een acuut en een convalescent serum met een tussentijd van 2-3 weken beschikbaar zijn en als in de anamnese blootstelling aan mogelijk geïnfecteerde vogels voorkomt. Bij populatieonderzoek, bijvoorbeeld om na te gaan of psittacose een rol speelt bij het verhoogd voorkomen van pneumoniën rond pluimveebedrijven, gaat het om blootstelling en infectie in het verleden. Een doorgemaakte infectie wordt dan vastgesteld op basis van een eenmalige hoge titer. Bij zowel diagnose als bij populatieonderzoek vormt de kruisreactiviteit van de huidige beschikbare serologische testen een groot probleem. De serologische diagnostiek ten bate van epidemiologisch onderzoek zou een belangrijk aandachtspunt moeten zijn voor onderzoekinstituten in de veterinaire en humane publieke gezondheid. In dit geval gaat het dan om een test die specifiek is voor antistoffen tegen C. psittaci en daardoor geen kruisreactie veroorzaakt met antistoffen tegen C. pneumoniae of andere Chlamydia-bacteriën.

Auteurs
W. van der Hoek 1, A.B. van Gageldonk-Lafeber 1, E.R. Heddema 2, D.W. Notermans 1, J.W. Den Boer 3, A. Nieuwenhuizen 1, A.M.L. Tjon-A-Tsien 4, F. Dijkstra 1, A. Meijer 1
- Centrum Infectieziektebestrijding, RIVM, Bilthoven
- Orbis Medisch Centrum, Sittard
- Streeklaboratorium Kennemerland, Haarlem
- GGD Rotterdam-Rijnmond, Rotterdam
Correspondentie
wim.van.der.hoek@rivm.nl
- Meijvis SC, Hardeman H, Remmelts HH, et al. Dexamethasone and length of hospital stay in patients with community-acquired pneumonia: a randomised, double-blind, placebo-controlled trial. Lancet 2011, 377: 2023-2030.
- Huijskens EG (Europese Gemeenschap), van Erkel AJ, Palmen FM, Buiting AG, Kluytmans JA, Rossen JW. Viral and bacterial aetiology of community-acquired pneumonia in adults. Influenza Other Respi Viruses 2013, 7: 567-573.
- van Gageldonk-Lafeber AB, Wever PC, van der Lubben IM, et al. The aetiology of community-acquired pneumonia and implications for patient management. Neth J Med 2013, 71: 418-425.
- van Gageldonk-Lafeber AB, Bogaerts MA, Verheij RA, van der Sande MA. Time trends in primary-care morbidity, hospitalization and mortality due to pneumonia. Epidemiol Infect 2009, 137: 1472-1478.
- Koene R, Hautvast J, Züchner L, et al. Local cluster of psittacosis after bird show in the Netherlands, November 2007. Euro Surveill 2007, 12(50): pii=3328.
- Berk Y, Klaassen CHW, Mouton JW, Meis JFGM. Een uitbraak van psittacose na een vogelbeurs. Ned Tijdschr Geneeskd 2008, 152: 1889-1892.
- Smit LA, van der Sman-de Beer F, Opstal-van Winden AW, et al. Q fever and pneumonia in an area with a high livestock density: a large population-based study. PLoS (Plos One) One 2012, 7(6):e38843.
- Verminnen K, Duquenne B, De Keukeleire D, et al. Evaluation of a Chlamydophila psittaci infection diagnostic platform for zoonotic risk assessment. J Clin Microbiol 2008, 46: 281-285.
- van der Bruggen T, Kaan JA, Heddema ER, van Hannen EJ, de Jongh BM. Snelle diagnostiek van psittacose met behulp van een recent ontwikkelde realtime-PCR (polymerase chain reaction). Ned Tijdschr Geneeskd 2008, 152: 1886-1888.
- Heddema ER, Beld MG, de Wever B, Langerak AA, Pannekoek Y, Duim B. Development of an internally controlled real-time PCR assay for detection of Chlamydophila psittaci in the LightCycler 2.0 system. Clin Microbiol Infect 2006, 12: 571-575.
- Heddema ER, van Hannen EJ, Duim B, et al. An outbreak of psittacosis due to Chlamydophila psittaci genotype A in a veterinary teaching hospital. J Med Microbiol 2006, 55: 1571-1575.
- Baron EJ, Miller JM (Joint meeting), Weinstein MP, et al. A guide to utilization of the microbiology laboratory for diagnosis of infectious diseases: 2013 recommendations by the Infectious Diseases Society of America (IDSA) and the American Society for Microbiology (ASM). Clin Infect Dis 2013, 57(4): e22-e121.
- Snijders BEP, van der Hoek W, Stirbu I, van der Sande MAB, van Gageldonk-Lafeber AB. General practitioners’ contribution to the management of community acquired pneumonia in the Netherlands: a retrospective analysis of primary care, hospital, and national mortality databases with individual data linkage. Prim Care Respir J 2013, doi: 10.4104/pcrj.2013.00085.