Dit artikel beschrijft een studie die tot doel had een verband te vinden tussen de dichtheid aan (intensieve) veehouderij en het voorkomen van zoönotische infectieziekten bij mensen binnen de GGD (Gemeentelijke Gezondheidsdienst)-regio’s van Nederland.
content
Auteur(s): G. Klous, J. van der Giessen
Infectieziekten Bulletin, jaargang 23, nummer 7, september 2012
Door het ontbreken van gegevens over niet-meldingsplichtige zoönosen bij mensen is besloten om het onderzoek te richten op de meldingsplichtige zoönosen. Daarvoor werd de volgende hypothese geformuleerd: ‘In gebieden met veel veeteelt komen meer humane zoönotische ziektegevallen voor dan in gebieden met weinig veeteelt’. Om dit te onderzoeken is een geografische analyse uitgevoerd, waarbij gebruik is gemaakt van geregistreerde meldingsplichtige zoönotische ziektegevallen bij mensen tussen 1988 en 2010, per GGD (Gemeentelijke Gezondheidsdienst)-regio, waarbij ook de dichtheid van de veestapel (2010) binnen de betreffende GGD-regio geanalyseerd is. Uit de lijst van meldingsplichtige infectieziekten, zijn een drietal zoönosen geselecteerd, die mogelijk een relatie hebben met de veehouderij, namelijk psittacose, leptospirose en Q-koorts. De veehouderij heeft in deze periode wel ontwikkelingen in schaalvergroting doorgemaakt, hoewel ook een groei van het aantal biologische bedrijven is geweest. Het aantal meldingen over de jaren zijn voor deze 3 zoönosen redelijk vergelijkbaar, met uitzondering van de Q-koortsepidemie in de periode 2007-2009. Hieruit kunnen we concluderen, dat deze zoönosen endemisch voorkomen in Nederland, bovendien zijn er voldoende patïent meldingen in deze periode geregistreerd om de analyse mogelijk te maken.
Zoönotische ziekteverwekkers kunnen van dieren op mensen worden overgedragen via direct contact, via een vector (bijvoorbeeld mug of teek) of via voedsel, water of lucht. (1,2) Een belangrijke voorwaarde voor overdracht van een (nieuw) zoönotisch pathogeen is regelmatig contact tussen mensen en gewervelde dieren (vertebraten). (9) Recentelijk beschreef Jones (2008) de meest waarschijnlijke locaties in de wereld waar nieuwe zoönosen konden ontstaan. In West-Europa valt met name Nederland op in deze publicatie. (3) Nederland is een van de dichtst bevolkte landen ter wereld (27, 28), gecombineerd met een zeer intensieve veeteeltindustrie (29), intensieve wereldwijde handelsactiviteiten (30) in de havens van Rotterdam en Amsterdam (31) en de luchthaven van Amsterdam. (32) Hierdoor ontstaat een risicogebied waarin zoönosen en andere besmettelijke dierziekten kunnen uitbreken. Dit wordt geïllustreerd door uitbraken van varkenspest (1997-1998) (4) mond- en klauwzeer (2001) (5), vogelgriep (2003), blauwtong (2006), Q-koorts (2007-2009) en Schmallenbergvirus (2011).(6, 7) De Nederlandse overheid heeft een lijst van 30 meldingsplichtige zoönosen opgesteld, waarvan er 14 meldingsplichtig zijn als zij zich voordoen bij mensen en dieren. De overigen zijn meldingsplichtig als zij zich voordoen bij mensen of dieren. (Tabel 1) Deze ziekten kunnen afhankelijk van de categorie gemeld worden door huisartsen, specialisten, medisch microbiologen en in geval van dierlijke ziektegevallen door boeren en of dierenartsen. Humane ziektegevallen worden gerapporteerd aan de Gemeentelijke Gezondheids Diensten (GGD’en) (33) en dierlijke ziektegevallen aan de Nederlandse Voedsel- en Warenautoriteit (NVWA (Nederlandse Voedsel- en Warenautoriteit)).(34) Psittacose wordt veroorzaakt door Chlamydohila psittaci. Deze bacterie kan overgedragen worden op mensen door vogels, met name papegaaien en kanaries, maar ook andere vogels die als huisdier worden gehouden.(10-12) Na aerogene besmetting, kan de bacterie de luchtwegen beschadigen en zelfs meervoudig orgaanfalen tot gevolg hebben.(10-12) Psittacose is zowel voor dieren als voor mensen meldingsplichtig en wordt derhalve geregistreerd. (8) Bronopsporing maakt het wellicht mogelijk om besmettelijke dieren op te sporen en te behandelen. Het is minder duidelijk of pluimvee een rol speelt in de transmissie naar de mens. Echter recent Belgisch onderzoek door Dickx en Vanrompay (2011) toont aan dat zowel bij kippen- als kalkoenbedrijven genotypen A, C en D werden gevonden en dezelfde genotypen ook werden gevonden bij humane patïenten met de ziekte. (22, 23)
Leptospirose wordt veroorzaakt door bacteriën die behoren tot de Leptospira interrogans-groep. Dit genus bestaat uit ongeveer 20 species en meer dan 200 pathogene Leptospira-serovars, geclusterd in serogroepen die zijn beschreven. Deze serogroepen zijn ingedeeld op basis van hun genetische en antigene verwantschap. Leptospira interrrogans serovar hardjo komt voor bij runderen, serovar icterohaemorhagiae in bruine ratten, de serovars sejroe en shermani kunnen voorkomen bij schapen en geiten en pomona en tarrasovi komen bij varkens voor. (13, 26) Leptospirose is endemisch in alle werelddelen. (13) Leptospira-bacteriën worden via urine van besmette dieren uitgescheiden en kunnen in water overleven (met name in de zomermaanden). Transmissie via gecontamineerd oppervlaktewater is dan ook de grootste bron van besmetting voor mensen. (13) In Nederland komt Leptospira hardjo nog maar weinig voor bij rundvee als gevolg van een bestrijdingsprogramma. Honden kunnen ook besmet raken met serovars canicola en icterohaemorhagiae, maar door vaccinatie van honden is leptospirose te voorkomen. (15) Echter, in de zomermaanden van 2006 was er wel een verhoogd risico voor besmetting van honden. (14)
Q-koorts wordt veroorzaakt door een infectie met de bacterie Coxiella burnetii. Dit is een veel voorkomende bacterie in dieren, vooral in herkauwers. (35) De bacterie wordt in grote hoeveelheden uitgescheiden door besmette vrouwelijke dieren, tijdens het werpen van jongen. Deze bacterie is resistent tegen droogte en de meeste desinfecterende middelen. (35) Vanwege deze resistentie kan de bacterie eenvoudig verspreid worden via contaminatie van de leefomgeving van de dieren en vervolgens verspreiding door de lucht. Dit gebeurde in Nederland tijdens de Q-koortsuitbraken van 2007-2009. Deze uitbraken zijn zeer gedetailleerd beschreven door Karagiannis et al (2009) en Schimmer et al (2010). (7, 16) Voor zowel dierlijke als humane ziektegevallen van Q-koorts is een surveillancesysteem actief.(8)
Materiaal en methoden
Meldingen van humane ziektegevallen van bovengenoemde meldingsplichtige zoönosen werden verkregen via de database Osiris van het RIVM. Voor dit onderzoek zijn de gegevens van psittacose, leptospirose en Q-koorts gebruikt uit de periode 1988 tot 9 oktober 2010. Deze bestanden werden overgezet naar MS (Multiple Sclerose) Excel. Waarna een Geografische Informatie Systeem (GIS (Geografic Information System)-)analyse werd gedaan. Het RIVM stelde een ArcGIS shapefile met de GGD-regio’s ter beschikking. Dit shapefile werd gebruikt als basis voor de geproduceerde kaarten. In het exceldocument werden ziektegevallen genoteerd gecombineerd met het aantal humane ziektegevallen per GGD-regio. Hierna werden dichtheden van specifieke veehouderijsystemen in de GGD-regiokaart bepaald. Dit werd gedaan door ArcGIS-rasterfiles, die hoeveelheden van verschillende veesoorten weergaven in Nederlandse Grootheids Eenheden (NGE) in de GGD-regiokaart te plotten. Dit is een onafhankelijke schaal voor de classificatie van veeteeltbedrijven. (36) Een hoge NGE-waarde voor een specifieke diersoort betekent veel dieren van deze groep in een gebied, dus een hoge dichtheid van deze veehouderijen in een gebied. Met NGE als maat kunnen veehouderijbedrijven met elkaar worden vergeleken, ook over de sectoren (diersoorten) heen. Vier rasterfiles, voor schapen en geiten, runderen, varkens en pluimvee, werden ter beschikking gesteld door het Landbouw Economisch Instituut (LEI (Landbouw Economisch Instituut)) in Wageningen. Alle kaarten werden geproduceerd met ArcGIS 9, Arcmap 9.3.1 (2009) van ESRI. Als voorbeeld werden de methoden van Berke (2005) en Friesema (2010) gebruikt. (17, 18) De data over de bevolkingssamenstelling van Nederland waren afkomstig van het Centraal Bureau voor de Statistiek (CBS (Centraal Bureau voor de Statistiek)) uit 2007. (38) De 3 geselecteerde zoönosen werden gekoppeld aan hun specifieke dierlijke gastheer; voor psittacose werd de NGE voor pluimvee gebruikt. Voor leptospirose werd de NGE voor rundvee, varkens en geiten en schapen gebruikt, daar deze diersoorten kunnen bijdragen aan de verspreiding van leptospirose. Q-koorts ziektegevallen werden gekoppeld aan de NGE-waarden voor schapen en geiten.
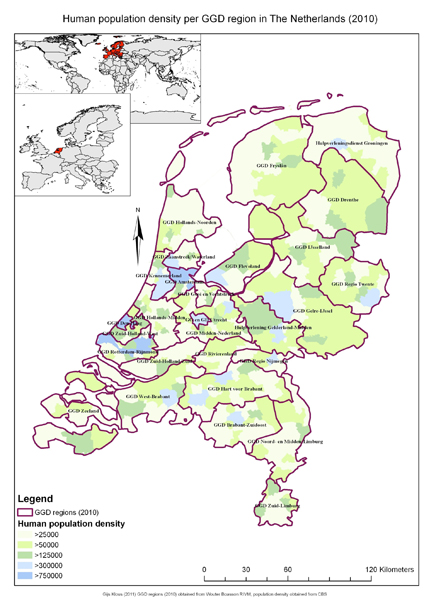
Figuur 1 Humane populatiedichtheid binnen GGD-regio’s (2010). De populatiedichtheid is per wijk, stedelijke gebieden (>300,000 inwoners) zijn blauw aangegeven. Gebieden met een lage populatiedichtheid (25,000>) zijn geel aangegeven. De namen van de GGD-regio’s zijn aangegeven in de betreffende regio. Deze namen worden als referentie gebruikt in het artikel. De wereld- en Europese referentiekaarten komen van: www.vdstech.com/map_dat.htm. (28, 37)
Resultaten
De humane populatie per GGD-regio in Nederland is weergegeven in figuur 1. De namen van de GGD-regio’s zoals aangegeven in figuur 1, worden als indicator voor de GGD-regio’s gebruikt in de rest van deze tekst. Het grootste aantal humane ziektegevallen voor psittacose werd gevonden in een gebied met een lage pluimveedichtheid, de GGD-regio Rotterdam-Rijnmond (N=174). De landelijke mediaan en het landelijke gemiddelde voor humane psittacosegevallen lagen respectievelijk op N=36 en N=39.8 ziektegevallen. Ondanks dat deze regio het hoogste aantal humane psittacosegevallen had, bleek dat de regio van Hulpverleningsdienst Gelderland-Midden met 74 ziektegevallen ook ver boven de landelijke mediaan en het landelijke gemiddelde lag. Evenals GGD-regio Midden-Nederland met N=64 gevallen. Deze laatste 2 regio’s worden gekenmerkt door de meest intensieve pluimveesector in Nederland. (Figuur 2) De GGD-regio Fryslân heeft de hoogste incidentie van humane ziektegevallen van leptospirose, namelijk 84, waar de landelijke mediaan en het landelijke gemiddelde liggen op respectievelijk: N=12.5 en N=17.3. De regio Fryslân behoort tot de regio’s met hoge concentraties runderen, varkens en schapen en geiten. (Figuur 3) GGD-regio Amsterdam valt ook op door de hoge leptospirose-incidentie en staat op de tweede plaats met N= 33 humane gevallen. Amsterdam heeft echter geen hoge veedichtheid. (Figuur 3) Tussen 2007 en 2009 werden voornamelijk de GGD-regio’s Hart voor Brabant en Brabant-Zuidoost getroffen door een Q-koortsepidemie. (7) Al in 2010 lieten Schimmer et al en Heederik et al een geografisch verband zien tussen geitenboerderijen en humane Q-koortsgevallen in dit gebied. (16, 24) In deze studie wordt ook aangetoond dat met een GIS-analyse een verband kan worden gevonden tussen de hoeveelheid schapen en geiten en de hoeveelheid humane Q-koortsziektegevallen binnen een gebied. (Figuur 4) In deze studie ligt de focus echter op een veel groter gebied dan in de studies van Schimmer en Heederik. (16, 24) In de GGD-regio Hart voor Brabant is een humane Q-koortsincidentie van N=2358. De GGD-regio Brabant-Zuidoost heeft een incidentie van N=501 humane Q-koortsziektegevallen. Deze aantallen zijn vergeleken met de landelijke mediaan, N=27.5 ziektegevallen. De incidentie van Q-koortsziektegevallen in deze 2 regio’s bepaalde voor een groot deel de hoogte van het landelijk gemiddelde van N=155.25 ziektegevallen. De GGD-regio Zuid-Limburg lag met het aantal humane Q-koortsziektegevallen boven zowel de landelijke mediaan als het gemiddelde (N=266). De GGD-regio’s Hart voor Brabant en Brabant-Zuidoost hebben een groot aantal schapen- en geitenbedrijven binnen de regio, het aantal bedrijven kan plaatselijk verschillen. (Figuur 4) Voor de regio Zuid-Limburg zijn de aantallen schapen- en geitenbedrijven nog meer plaatselijk geconcentreerd dan in de Brabantse regio’s, met vooral een hoge concentratie schapen en geiten centraal gelocaliseerd in de GGD-regio.
Figuur 2: Humane psittacose-incidentie in Nederland vergeleken met pluimveedichtheid per GGD-regio. Blauw geeft de pluimveedichtheid weer, rood de humane psittacoseziektegevallen. De intensiteit van de kleur geeft de dichtheid/incidentie weer, donker is een grote dichtheid/incidentie. De roodomlijnde regio is GGD Rotterdam-Rijnmond, de regio met de hoogste psittacose-incidentie (N=174).
Figuur 3: Humane leptospirose-incidentie in Nederland vergeleken met de dichtheid voor runderen, varkens, schapen en geiten. Blauw geeft de hoeveelheid vee weer, rood de humane leptospiroseziektegevallen. De intensiteit van de kleur geeft de hoeveelheid/incidentie weer, donker is een grote hoeveelheid/incidentie. De roodomlijnde regio is GGD Fryslân, de regio met de hoogste leptospirose-incidentie (N=84)
Figuur 4: Humane Q-koortsincidentie in Nederland vergeleken met hoeveelheid schapen en geiten per GGD-regio. Blauw geeft de hoeveelheid schapen en geiten weer, rood de humane Q-koortsziektegevallen. De intensiteit van de kleur geeft de hoeveelheden/incidentie weer, donker is een grote hoeveelheid/incidentie. De roodomlijnde regio’s zijn van GGD Hart voor Brabant (N=2358), GGD Brabant- Zuidoost (N=501) en GGD Zuid-Limburg (N=266), de regio’s met de hoogste Q-koortsincidentie.
Discussie
Het doel van dit onderzoek was om een verband te vinden tussen de dichtheid van veehouderijsystemen en het voorkomen van zoönotische infectieziekten bij mensen in Nederland. Dit is eerder beschreven voor E. coli (Escherichia coli) O157 en Q-koorts door respectievelijk Friesema, Schimmer en Heederik. (16, 17, 24) In eerste instantie waren we geïnteresseerd om dit verband ook voor niet meldingsplichtige zoönosen te bestuderen, maar dit bleek onmogelijk door het ontbreken van de gegevens. Daarom werd dit onderzoek uitgevoerd aan de hand van 3 zoönosen: psittacose, leptospirose en Q-koorts, die endemisch voorkomen in Nederland en waarvoor voldoende humane patiënten gemeld worden om dit verband te kunnen bestuderen. De hypothese die werd getoetst luidde ‘In gebieden met veel veeteelt komen meer humane zoönotische ziektegevallen voor dan in gebieden met weinig veeteelt’.
De hoogste incidentie van psittacose is in de GGD-regio Rotterdam-Rijnmond, terwijl in deze regio heel weinig pluimvee wordt gehouden (NGE ≥4). Een verklaring hiervoor kan liggen in het feit dat er mogelijk in Rotterdam-Rijnmond relatief veel vogels als huisdier worden gehouden. In de literatuur wordt dit als een belangrijke bron beschreven. (10) Een tweede verklaring is mogelijk de hoge prevalentie van psittacose in de stadse duivenpopulatie. Voor Amsterdam werd een hoge prevalentie van psittacose in de duivenpopulatie al eerder aangetoond door Heddema et al in 2006. (21) Het is de vraag of pluimvee wel een reservoir is voor C. psittaci (chlamydia psittaci) en daardoor van belang voor de mens. Uit de literatuur blijkt dat de genotypes A, C en D zowel bij pluimvee als mensen worden gevonden, maar of dit ook in Nederland geldt is vooralsnog onbekend. (22, 23) De hoge incidentie van psittacose in de regio’s GGD Midden-Nederland en Hulpverlening Gelderland- Midden zou mogelijk wel verband kunnen hebben met pluimvee omdat deze regio’s tot de gebieden met de meest intensieve pluimveehouderij behoren. Deze mogelijke associatie moet verder onderzocht worden, met name welke genotypen bij mensen en pluimvee in dit gebied voorkomen. Leptospirose is vooral aanwezig in GGD-regio’s Fryslân en Midden-Nederland en Hulpverleningsdienst Groningen. Dit zijn gebieden waar veel runderen, varkens en schapen en geiten worden gehouden. De hoge incidentie van leptospirose in Fryslân kan indirect verband houden met de leptospiren die via de urine van de dieren in het oppervlaktewater kunnen komen of direct via contact met vee. (19, 20) De meest voorkomende serovar in Fryslân is L. Icterohaemorhagiae. Deze serovar komt voor in ratten en wordt ook door hen verspreid. Ratten komen vaak voor in de omgeving van oppervlaktewater en mogelijk ook bij de Friese meren waar veel waterrecreatie is en dus veel mensen blootgesteld worden aan besmetting Voor de Friese leptospirosepatiënten geldt dat van een groot deel niet vermeld is welke serovar een rol heeft gespeeld. Voor 3 Friese leptospirosepatiënten is er echter een verband met runderen (Osiris 9). Deze werden namelijk veroorzaakt door L. interrogans serovar Hardjo. Amsterdam heeft de op een na hoogste incidentie van leptospirose wat mogelijk veroorzaakt wordt door de vele ratten in de grachten. Een andere mogelijke verklaring voor de hoge incidentie van leptospirose in Amsterdam is het voorkomen van in het buitenland opgelopen infecties. Deze infecties worden pas in Nederland geïdentificeerd en door het Koninklijk Instituut voor de Tropen in Amsterdam gediagnosticeerd. (39) Naast de diagnose leptospirose is een identificatie van de veroorzaker cq. serovar nodig om iets over de bron te kunnen zeggen. Bij Q-koorts werd in 2010 door Schimmer et al en in 2011 door Heederik et al, met een GIS-analyse al een verband gevonden tussen schapen- en geitenbedrijven en het voorkomen van Q-koortspatiënten in een specifiek gebied. (16, 24) In onze studie zijn nog meer patiënten uit Osiris geanalyseerd en werd aangetoond dat Q-koorts vooral een probleem is in de agrarische gebieden: Hart voor Brabant, Zuid-Oost Brabant en Zuid-Limburg. (Figuur 4) Er waren echter meer gebieden met een hoge Q-koortsincidentie bij mensen vergeleken met de landelijke mediaan en het landelijke gemiddelde. Dit waren de gebieden Regio Nijmegen, Midden-Nederland, Rotterdam-Rijnmond, Rivierenland en Noord-Limburg. In deze gebieden zijn grote schapen- of geitenbedrijven gevestigd. Er kan geconcludeerd worden dat er een verband is tussen de schapen- en geitenhouderij - met name de melkproducerende dieren - en het voorkomen van Q-koorts onder mensen. (25) Wij hebben geconstateerd dat de hypothese ‘in gebieden met veel veeteelt komen meer humane zoönotische ziektegevallen voor, dan in gebieden met weinig veeteelt’ op gaat voor Q-koorts. (25) Echter voor psittacose en leptospirose suggereren de uitkomsten dat ook andere dieren een rol spelen als bron van infectie. Gericht nader onderzoek is nodig om na te gaan of en welke rol de veehouderij in de totale ziektelast speelt. Een geïntegreerde monitoring van mens en dier voor relevante (meldingsplichtige) zoönosen kan tot een snellere identificatie van locale risico’s en dus tot maatregelen leiden. Naast geografische analyses, is een vergelijking (typering) van de geïsoleerde verwekkers bij mens en dier, die een overdracht van dier op mens aannemelijk kunnen maken, van essentieel belang.
Auteurs
G.Klous (1), J. van der Giessen (2)
- MSc (master of science)-student faculteit Aard- en levenswetenschappen, Vrije Universiteit, Amsterdam
- Centrum Infectieziektebestriiding, RIVM, Bilthoven
Correspondentie
J. van der Giessen | Joke.van.der.Giessen@rivm.nl
Dit artikel is een bewerking van de literatuurscriptie Geographic analyses of a link between livestock husbandry and the ocurrence of zoonoses in humans, in the Netherlands, Gijs Klous (2011) voor de Master Biomedical Sciences Vrije Universiteit Amsterdam, begeleid door J. van der Giessen, RIVM, Bilthoven.
- Webber R. (2009) Communicable disease Epidemiology and Control: a global perspective 3th edition Cambridge University Press, ISBN: 978 1 84593 504 7
- Hutchinson ML, Walters LD, Moore T, et al. (2005) Fate of Pathogens Present in Livestock Wastes Spread onto Fescue Plots Appl. Environ.Microbiol.71:2, 691–696
- Jones KE, Patel NG, Levy MA, et al. (2008) Global trends in emerging infectious diseases Nature 451, 990-994
- Crauwels APP, Nielen M, Elbers ARW, et al. (2003) Neighbourhood infections of classical swine fever during the 1997–1998 epidemic in The Netherlands Preventive Veterinary Medicine 61, 263–277
- Pluimers FH (Familiaire Hypercholesterolemie), Akkerman AM, Van der Wal P, et al. (2002) Lessons fromthe foot and mouth disease outbreak in The Netherlands in 2001 Rev.Sci. Tech.21:3, 711-721
- Koopmans M, Wilbrink B, Conyn M, et al. (2004) Transmission of H7N7avian influenza A virus to human beings during a large outbreak in commercial poultry farms in the Netherlands Lancet 363, 587–593
- Karagiannis I, Schimmer B, Van Lier A, et al. (2009) Investigation of a Q fever outbreak in a rural area of The Netherlands Epidemiol. Infect. 137, 1283–1294
- Van Pelt W, Braks MAH, Schimmer B, et al. (2009) Staat van zoönosen 2007-2008 RIVM-rapport 330131001
- Graveland H, Wagenaar JA, Bergs K, et al. (2011) Persistence of Livestock Associated MRSA (Methicilline-resistente Staphylococcus aureus) CC398 in Humans Is Dependent on Intensity of Animal Contact PLoS (Plos One) ONE 6:2, e16830
- Heddema ER, Van Hannen EJ, Duim B, et al. (2006) Genotyping of Chlamydophila psittaci in Human Samples Emerging Infectious Diseases 12:12, 1989-1990
- Jorn KS, Thompson KM, Larson JM (Joint meeting) and Blair JE. (2009) Polly can make you sick: Pet bird-associated diseases Cleveland Clinic J. of Med. 76:4, 235-243
- Heddema ER, Van Hannen EJ, Duim B, et al. (2006) An outbreak of psittacosis due to Chlamydophila psittaci genotype A in a veterinary teaching hospital Journal of Medical Microbiology 55, 1571–1575
- 13. Bahrti AR, Nally JE, Gilman RH, et al. (2003) Leptospirosis: a zoonotic disease of global importance Lancet Infect. Dis. 3, 757–771
- Scheepstra DR and Lipman LJ. (2006) Swimming in summer Tijdschr. Diergeneeskd. 131:20, 742-744
- Wang Z, Jin L and Wegrzyn A (2007) Leptospirosis vaccines Microbial Cell Factories 6:39
- Schimmer B, Ter Schegget R, Wegdam M, et al. (2010) The use of a geographic information system to identify a dairy goat farm as the most likely source of an urban Q-fever outbreak BMC Infectious Diseases 10:69
- Friesema IHM, Van de Kassteele J, De Jager CM, et al. (2010) Geographical association between livestock density and human Shiga toxin-producing Escherichia coli O157 infections Epidemiol. Infect. available on: http://journals.cambridge.org/
- Berke O. (2005) Exploratory spatial relative risk mapping Preventive Veterinary Medicine 71, 173–182
- Brockmann S, Piechotowski I, Bock-Hensley O, et al. (2010) Outbreak of leptospirosis among triathlon participants in Germany, 2006 BMC Infectious Diseases 10:91
- Arthurson V. (2008) Proper Sanitization of Sewage Sludge: a Critical Issue for a Sustainable Society Applied and Environmental Microbiology 74:17, 5267–5275
- Heddema ER, Ter Sluis S, Buys JA et al (2006) Prevalence of Chlamydophila psittaci in Fecal Droppings from Feral Pigeons in Amsterdam, The Netherlands Applied and Environmental Microbiology 72:6, 4423–4425
- Dickx V, Geens T, Deschuyffeleer T et al (2010) Chlamydophila psittaci Zoonotic Risk Assessment in a Chicken and Turkey Slaughterhouse Journal of Clinical Microbiology 48:9, 3244–3250
- Dickx V and Vanrompay D (2011) Zoonotic transmission of Chlamydia psittaci in a chicken and turkey hatchery Journal of Medical Microbiology 60, 775–779
- Heederik DJJ, Ijzermans CJ, red. Mogelijke effecten van intensieve veehouderij op de gezondheid van omwonenenden± onderzoek naar potentiele blootstelling en gezondheidsproblemen. Rapport IRAS (Institute of Risk Assessment Sciences), Universiteit Utrecht, NIVEL (Nederlands instituut voor onderzoek van de gezondheidszorg) en RIVM, 7 juni 2011.
- Roest HI, Tilburg JJ, van der Hoek W et al (2011) The Q fever epidemic in The Netherlands: history, onset, response and reflection. Epidemiol Infect. 139:1, 1-12
- Lilenbaum W, Vargas R, Ristow P et al (2009) Identification of Leptospira spp (species). carriers among seroreactive goats and sheepby polymerase chain reaction Research in Veterinary Science 87, 16–19
- http://esa.un.org/unpp/p2k0data.asp
- http://www.cbs.nl/nl-NL/menu/home/default.htm
- http://kids.fao.org/glipha/
- http://www.wto.org/english/res_e/statis_e/its2004_e/its04_world_maps_e…
- http://www.mapsofworld.com/world-sea-ports-map.htm
- http://www.infoplease.com/ipa/A0004547.html
- http://www.ggd.nl/
- http://www.vwa.nl/