Antivirale middelen worden gezien als waardevolle aanvulling op het gebruik van influenzavaccins. In deze bijdrage een analyse van resistentieontwikkeling bij beide klassen antivirale middelen. De les: continue waakzaamheid en monitoring is geboden.
content
Auteur(s): M. Jonges, A.Meijer
Infectieziekten Bulletin, jaargang 23, nummer 3, maart 2012
Influenza is een infectie van de hogere luchtwegen die veroorzaakt wordt door het influenza A of B-virus. Ondanks dat jaarlijks tussen de 7 en 20% van de wereldbevolking geïnfecteerd raakt, herstellen de meeste personen binnen 1 á 2 weken zonder behandeling. Toch overlijden in Nederland gedurende de wintermaanden naar schatting tussen de 1000 en 2000 mensen (in het bijzonder baby’s, volwassenen met een verminderde weerstand en ouderen) direct of indirect aan de gevolgen van een influenzavirusinfectie.
Vaccinatie is de voornaamste manier om te beschermen tegen influenzavirusinfectie bij deze risicogroepen, maar antivirale middelen worden gezien als een waardevolle aanvulling op het gebruik van influenzavaccins. In het huidige Nederlandse beleid worden antivirale middelen gebruikt bij een verminderd effectief influenzavaccin, bij influenza-uitbraken in verpleeghuizen en bij de behandeling van immuungecompromitteerde ziekenhuispatiënten. Daarnaast is in Nederland een grote hoeveelheid oseltamivir (Tamiflu®) opgeslagen die tijdens een influenzapandemie kan worden ingezet als er nog geen passend vaccin beschikbaar is.
Twee klassen
Er zijn 2 verschillende klassen antivirale middelen op de markt die fundamenteel van elkaar verschillen op basis van hun binding aan het influenzavirus. Tot de eerste klasse behoren de adamantane derivaten amantadine (Symmetrel®) en rimantadine (Flumadine®) die aan het M2-ionkanaal van influenza A-virussen binden en het blokkeren zodat de virusreplicatie onderbroken wordt. De tweede klasse is die van de de neuraminidaseremmers (NRs) oseltamivirfosfaat (Tamiflu®) en zanamivir (Relenza®) die het geconserveerde en actieve centrum van het neuraminidase-enzym (NA) van de influenzavirussen type A en B binden waardoor het virus zich niet kan losknippen van de geïnfecteerde cel en de infectie zich niet kan verspreiden. Oseltamivirfosfaat wordt als prodrug oraal toegediend en wordt in de lever gehydrolyseerd tot de actieve drug oseltamivir carboxylaat. Hierdoor biedt oseltamivir naast bescherming van de luchtwegen ook een bescherming tegen systemische infecties met influenzavirus. Zanamivir wordt met een inhalator toegediend en beschermt alleen de luchtwegen.
Adamantanes
Ondanks het gegeven van decennialang adamantanegebruik gecombineerd met een snelle resistentieontwikkeling tijdens therapie met adamantanes, bleef het aantal adamantaneresistente influenzavirussen in de populatie laag. Afgelopen decennium werden wereldwijde influenza A(H3N2)-virussen echter gekenmerkt door een sterke toename van adamantaneresistente virusmutanten, veroorzaakt door een enkele aminozuursubstitutie in het M2-ionkanaal. In Nederland steeg het percentage adamantaneresistente A(H3N2)-virussen van 74% in 2005–2006 naar 100% in 2007–2008. (1). Na de mondiale verspreiding van adamantaneresistente A(H3N2)-influenzavirussen, is een subgroep van seizoens A(H1N1)-influenzavirussen ook van nature adamantaneresistent geworden, terwijl ook het 2009 pandemische A(H1N1)-virus van nature resistent is tegen deze klasse van antivirale middelen. (2). In Nederland werden adamantanes wegens bijwerkingen (concentratieproblemen, duizeligheid, huiduitslag, maagklachten nervositeit en sufheid), snelle resistentievorming tijdens therapie en afwezige effectiviteit tegen type B-influenzavirussen zelden voorgeschreven. Nu de huidige circulerende influenza A-virussen van nature resistent zijn tegen deze middelen hebben ze geen betekenis voor de behandeling van of profylaxe tegen influenza.
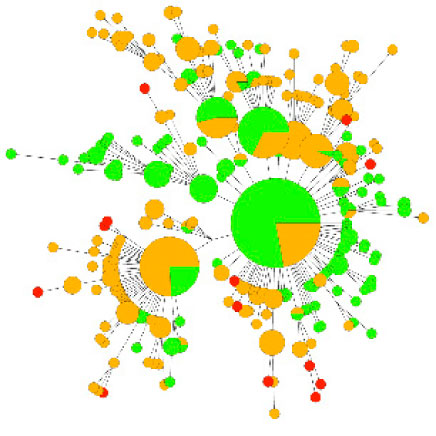
Figuur 1 Fylogenetisch netwerk op basis van 665 Nederlandse pandemische influenzavirus A(H1N1) NA en PB2 sequenties demonstreert het sporadisch ontstaan van resistente influenzavirusvarianten die vervolgens niet spreiden in de populatie. In groen zijn virussen van de zomer 2009 weergegeven, in geel virussen van de epidemie in het najaar van 2009 en in rood oseltamivirresistente virussen. De kleinste cirkels vertegenwoordigen één enkel virus en de grootte van de cirkel neemt evenredig toe naarmate er meer virussen identiek zijn. De kleinste afstand tussen 2 cirkels komt overeen met één nucleotide verandering.
Neuraminidaseremmers
In tegenstelling tot adamantanes werd tot enkele jaren terug van de neuraminidaseremmers verwacht dat het influenzavirus moeilijker resistentie tegen deze middelen zou ontwikkelen. Neuraminidaseremmers binden het actieve centrum van het NA-enzym en mutaties die resistentie veroorzaken leiden tot een kreupel virus met een verminderde NA-activiteit. Infectiestudies met diermodellen lieten zien, dat mutanten resistent tegen neuraminidaseremmers minder fit en ziekmakend waren en het werd daarom verondersteld dat deze mutanten nauwelijks een rol van betekenis zouden kunnen spelen tijdens influenza-epidemieën. Wereldwijde surveillancestudies naar resistentie onder circulerende virussen rapporteerden tot aan het influenzaseizoen 2007-2008 over percentages resistente influenzavirussen van minder dan 1% (3), zelfs in landen met een relatief hoog NRs gebruik zoals Japan, alhoewel tijdens behandeling bij met name kinderen tot wel 16% resistentie werd gevonden. Het Europese griepseizoen 2007-2008 werd dan ook onverwacht gekenmerkt door gebruik van neuraminidaseremmers, percentages circulerende oseltamivirresistente A(H1N1)- influenzavirussen, waarna deze resistente variant zich wereldwijd verspreidde en domineerde. (4) Al deze A(H1N1)-virussen hadden een aminozuurverandering van histidine naar tyrosine op positie 275 in het NA-eiwit, kortweg H275Y. Deze verandering leidde tot oseltamivirresistentie terwijl de virussen gevoelig bleven voor zanamivir en adamantanes. Ook bleek dat deze oseltamivirresistente variant dezelfde klinische en epidemiologische eigenschappen had als gevoelige A(H1N1)-virussen. Dit gegeven leidde tot bezorgdheid omtrent de antivirale behandelbaarheid van pandemische influenza A(H1N1)-virusinfecties tijdens en na de introductie van dit nieuwe virus in mensen in 2009.
Pandemische influenza
Virologische analyse van de eerste 2009 pandemische A(H1N1)-virusisolaten door Rungrotmongkol et al. toonde reeds aan dat dit virus resistent was tegen adamantanes, maar gevoelig voor de neuraminidaseremmers oseltamivir en zanamivir. In Nederland werd oseltamivir ingezet voor de behandeling van en profylaxe tegen influenza-virusinfecties vanaf de eerste Nederlandse pandemische A(H1N1)-virusinfectie eind april 2009. Gelijktijdig werden de virologische surveillanceprotocollen uitgebreid met monitoring voor virulentiemutaties en extensieve monitoring voor antivirale resistentiemutaties. In de ruim 1100 onderzochte Nederlandse virussen is in totaal bij 19 personen een oseltamivirresistente virusinfectie gedetecteerd die gekarakteriseerd werd door de substitutie H275Y in het NA-enzym. (5). Vergelijkbaar met de situatie voor 2007-2008 waarbij circulerende virussen resistent tegen neuraminidaseremmers alleen sporadisch gedetecteerd werden, is in Nederland bij slechts één onbehandelde patiënt een resistente pandemische virusinfectie geïdentificeerd.
Naast de detectie van resistentiemutaties zijn er op nucleotideniveau vele kleine veranderingen in het RNA (ribonucleic acid) gedetecteerd tussen virussen afkomstig van verschillende patiënten. Dit zijn voornamelijk kopieerfouten die tijdens de virusvermenigvuldiging in het genetisch materiaal van het virus sluipen en die vervolgens van patiënt naar patiënt worden doorgegeven. Dankzij deze onvolkomenheid in de vermenigvuldiging van influenzavirussen, was het mogelijk om transmissieketens in kaart te brengen en is gedurende de pandemie afwezigheid van nationale verspreiding van oseltamivirresistente virusvarianten aangetoond. (Figuur 1) (5) Afwezigheid van oseltamivirresistente virussen in de populatie en in contacten van patiënten met resistent virus suggereert dat het ontstaan en de verspreiding van resistente pandemische virussen zeer beperkt was, mogelijk veroorzaakt door een kreupel virus met een verminderde NA-activiteit. Echter, een cluster van oseltamivirresistente transmissie in Australië zonder aanwijzing voor associatie met oseltamivirtherapie laat zien dat het pandemische A(H1N1)-virus het ook in zich heeft om van nature resistent tegen oseltamivir te worden. Continue waakzaamheid en monitoring is dus geboden.
Auteurs
M. Jonges, A.Meijer, Centrum voor Infectieziektebestrijding, RIVM, Bilthoven
Correspondentie:
M. Jonges | marcel.jonges@rivm.nl
Literatuur
- Jonges M, van der Lubben IM, Dijkstra F, Verhoef L, Koopmans M, Meijer A. Dynamics of antiviral-resistant influenza viruses in the Netherlands, 2005-2008. Antiviral Res. Sep 2009;83(3):290-297.
- Deyde VM (Verkennende Monitoring), Xu X, Bright RA, et al. Surveillance of resistance to adamantanes among influenza A(H3N2) and A(H1N1) viruses isolated worldwide. J Infect Dis. Jul 15 2007;196(2):249-257.
- Sheu TG, Deyde VM, Okomo-Adhiambo M, et al. Surveillance for neuraminidase inhibitor resistance among human influenza A and B viruses circulating worldwide from 2004 to 2008. Antimicrob Agents Chemother. Sep 2008;52(9):3284-3292.
- Lackenby A, Hungnes O, Dudman SG, et al. Emergence of resistance to oseltamivir among influenza A(H1N1) viruses in Europe. Euro Surveill. Jan 31 2008;13(5).
- Meijer A, Jonges M, Abbink F, et al. Oseltamivir-resistant pandemic A(H1N1) 2009 influenza viruses detected through enhanced surveillance in the Netherlands, 2009-2010. Antiviral Res. Jul 15 2011.