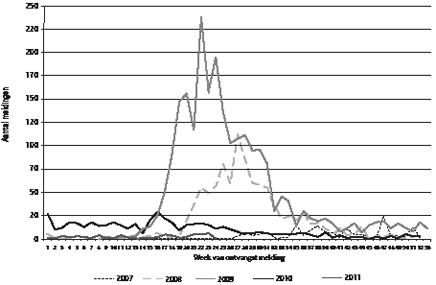
Y.T.H.P. van Duynhoven, P. Wever, F. Dijkstra, W. van der Hoek, H.J. Roest, C. Wijkmans, P. Vellema , T. Oomen, J.E. van Steenbergen In 2008 en 2009 is er vooral in zuidelijk Nederland sprake geweest van een groot aantal Q-koorts-patiënten (zie figuur). Vooral aan de bron (besmette melkgeitenbedrijven) zijn veel preventiemaat-regelen genomen, waarna het aantal patiënten afnam. Het grote aantal ziektegevallen bood echter de gelegenheid om onderzoek te doen naar humane en veterinaire aspecten van de ziekte, verwekker, verspreiding en bestrijding. Het Nederlandse Q-koortsonderzoek kenmerkt zich door nauwe samenwerking tussen het humane en veterinaire veld. In dit artikel geven we een overzicht van de belangrijkste bevindingen uit inmiddels afgerond onderzoek.
Q-koorts bij de mens
Voorkomen van Q-koorts
Q-koorts was vóór 2007 bij mensen een zeldzame infectie (seroprevalentie in 2006 ruim 2%, zonder aantoonbare geografische verschillen) (1) en een zelden gemelde ziekte (jaarlijks gemiddeld 17 meldingen). In de 2 jaren voorafgaand aan 2007, toen Q-koorts al wel was vastgesteld op melkgeitenbedrijven met een abortusstorm, zijn enkele humane regionale clusters van Q-koorts vermoedelijk onopgemerkt gebleven. (2) Het aantal meldingen van acute Q-koorts lag in 2010 met 506 ziektegevallen beduidend lager dan in 2009 maar is nog steeds hoger dan in vrijwel elk ander land in de wereld. Door de toegenomen aandacht voor Q-koorts daalde het diagnostisch en therapeutisch delay bij patiënten gedurende opeenvolgende epidemische seizoenen. (3)
Ziektebeloop en behandeling
Het percentage patiënten dat in het
ziekenhuis werd opgenomen ligt sinds 2008 rond de 20% van de
gemelde (symptomatische ) gevallen. Dat zou overeenkomen met
ongeveer 8% van alle infecties en is daarmee hoger dan de 2-5% die
in de internationale literatuur wordt vermeld. (4) Tussen 1 januari
2007 en 31 december 2010 zijn 4028 patiënten gemeld; van 20 is
bekend dat zij zijn overleden. Patiënten met onderliggend lijden
overlijden zeer zelden aan een acute Q-koortsinfectie. (5) Bij deze
patiënten is chronische Q-koorts vaker de doodsoorzaak. Uit
onderzoek naar de ziektelast van de epidemieën in 2007 en 2008
blijkt dat 40% van de patiënten 12 tot 26 maanden na een acute
Q-koortsinfectie nog klinisch relevante subjectieve klachten heeft
met functionele beperkingen en een verminderde kwaliteit van leven.
(6) Bij patiënten uit de regio Herpen was 1 jaar na acute Q-koorts
sprake van een significant verhoogd voorkomen van chronische
vermoeidheid (na 6 maanden bij circa de helft, na 12 maanden bij
25%) en verminderde kwaliteit van leven. (7) Retrospectief
onderzoek liet zien dat tijdige behandeling met een (vooral hoge
dosering) doxycycline in vergelijking met andere antibiotica tot
minder ziekenhuisopnames leidt. (8)
Exacte cijfers over chronische Q-koortspatiënten zijn niet
beschikbaar, omdat chronische Q-koorts niet meldingsplichtig is en
bovendien ook kan optreden na een subklinische of anderszins niet
herkende acute infectie. Wel kon een groep van 686 patiënten met
acute Q-koorts in het Jeroen Bosch Ziekenhuis meer dan 1 jaar
worden gevolgd. Daarvan ontwikkelden 12 patiënten (1,7%) chronische
Q-koorts overeenkomstig de 1-2% in de literatuur, 1 patiënt
overleed. (9) Vier grote medische centra zijn gestart met een
database voor chronische Q-koortspatiënten waarin tot medio 2011
187 personen zijn opgenomen. Recent gestart onderzoek probeert meer
inzicht te krijgen in de vele vragen die nog rondom chronische
Q-koorts blijven bestaan.
Risicogroepen voor infectie
Hoewel Q-koorts in de internationale literatuur hoofdzakelijk als een beroepsziekte wordt aangeduid, is dit in Nederland niet het geval. In 2010 is bij 6,5% van de meldingen (32/492) aangegeven dat de ziekte het meest waarschijnlijk is opgelopen tijdens de beroepsuitoefening. In eerdere jaren (2007-2009) is van 2421 gemelde patiënten het beroep bekend: 78 patiënten (3,2%) werkten in de agrarische sector, 20 (0,8%) in de dierverzorging en minder dan 0,5% in diertransport, vleesverwerkende industrie en wolproductie (Dijkstra et al., ongepubliceerde data). In Nederland levert vooral het ‘wonen op kortere afstand (minder dan 5 km (kilometer)) van besmette melkgeitenbedrijven’ een sterk verhoogd risico op Q-koorts. (10) Dit geldt ook nog in 2010 waardoor omwonenden in omvang de belangrijkste risicogroep vormt. Toch komen ook in Nederland infecties bij de uit de literatuur bekende risicogroepen op grote schaal voor. Tussentijdse resultaten van onderzoek naar Q-koorts onder dierenartsen en geitenhouders in 2009 en 2010 heeft laten zien dat bij deze beroepsgroepen een meerderheid een infectie heeft doorgemaakt (70-90% vergelijkbaar met cijfers uit 1985). (1) Ook zijn er recente infecties opgetreden. Bovendien bleek dat circa een vijfde van de medewerkers betrokken bij het ruimen van drachtige geiten op Q-koortspositieve bedrijven, ondanks hygiëneadviezen een Coxiella-infectie had doorgemaakt. (2)
Figuur Aantal gemelde Q-koortspatiënten naar week van melding. Week 1 van 2007 t/m week 24 van 2011.
Risicogroepen voor gecompliceerd beloop
Vrouwen met een acute infectie
tijdens de zwangerschap lopen een verhoogd risico op chronische
infectie. Er zijn signalen dat infectie is geassocieerd met
een negatieve zwangerschapsuitkomst. Conform verwachting liet het
retrospectieve seroprevalentie-onderzoek bij zwangere
vrouwen in 2007 en 2008 een verhoogd infectierisico zien in de
omgeving van Herpen (seroprevalentie ruim 15%), ten opzichte van
zwangere vrouwen elders in Noord-Brabant (circa 4%) en daarbuiten
(1%). (11)
Uit vergelijking van de uitslagen van het Jeroen Bosch Ziekenhuis
uit de zwangerenscreening (12e zwangerschapsweek) met gegevens van
het Perinatale Register Nederland bleek positieve serologie
(asymptomatische Q-koorts) geen relatie te hebben met
vroeggeboorte, een laag geboortegewicht of perinatale sterfte. De
Rijksuniversiteit Groningen is in 2010 een gerandomiseerd
cliëntcontrole onderzoek gestart om dit prospectief te onderzoeken
en na te gaan of dit ook op gaat voor zwangere vrouwen met
klinische Q-koorts. (12)
Ook mensen met bepaalde hartklep- en vaataandoeningen lopen na
acute infectie een verhoogd risico op chronische infectie. In een
aantal centra in Noord-Brabant namen medisch specialisten het
initiatief tot screenen van hun hoogrisicopatiënten. Daarvan zijn
nog geen gegevens beschikbaar. In december 2010 is via de
huisartsen in Nederland een vaccinatieaanbod gedaan aan deze
hoogrisicopersonen. Hiervoor wordt gebruik gemaakt van het in
Australië ontwikkelde vaccin. De huisartsen hebben ruim 2700
hoogrisicopersonen aangemeld vaccinatie en voorafgaande screening
op reeds doorgemaakte infectie. De GGD (Gemeentelijke Gezondheidsdienst) Hart
voor Brabant heeft bij bijna 1800 patiënten een huidtest uitgevoerd
en hen gescreend op antistoffen en ruim 1350 patiënten
daadwerkelijk gevaccineerd. Door het UMC (Universitair Medisch Centrum) St Radboud is begeleidend
onderzoek verricht naar de diagnostiektest.
Diagnostiek, therapie, doorverwijzen
Dankzij invoering van een PCR (polymerase chain reaction) voor Coxiella burnetii in bloed kan acute Q-koorts eerder dan voorheen in het ziekteverloop worden aangetoond. (13, 14) Interpretatie van serologische bevindingen wordt echter bemoeilijkt doordat veel mensen in Zuid-Nederland de afgelopen jaren een asympomatische infectie hebben doorgemaakt. Persisterende IgM (immuunglobuline M)-antistoffen tegen fase II-antigenen (vroege antistoffen) na infectie en stijgende titers bij een bijkomende infectie kunnen namelijk leiden tot een onterechte diagnose van acute Q-koorts. Een werkgroep Diagnostiek Q-koorts heeft daarom een advies ‘Laboratoriumdiagnostiek van acute Q-koorts’ opgesteld waarin een onderscheid wordt gemaakt tussen de diagnoses ‘acute Q-koorts’ en ‘mogelijk acute Q-koorts’. (15) Bij chronische Q-koorts kan PCR C. burnetii aantonen in bloed en weefsels (hartklep, vaatwand, placenta). Dit lijkt een beter criterium voor de diagnose chronische Q-koorts dan interpretatie van serologische bevindingen. (16) De eerder genoemde werkgroep heeft eveneens een advies ‘Laboratoriumdiagnostiek chronische Q-koorts’ opgesteld. (17)
Q-koorts bij dieren en vectoren
Voorkomen bij kleine herkauwers
In heel Nederland wordt Q-koorts al langere tijd bij kleine herkauwers waargenomen. In 2008 waren geiten- en schapensera voor 7,8% respectievelijk 2,4% positief. De seroprevalentie is duidelijk het hoogst in het zuiden van het land. (18)
Om beter te weten waar mogelijk nieuwe bronnen ontstaan is Q-koorts bij melkschapen en melkgeiten in juni 2008 meldingsplichtig geworden (criterium was meer dan 5% vroeggeboortes veroorzaakt door C. burnetii op een bedrijf). Op deze manier zijn 30 bedrijven gemeld waarvan bekend is dat er een C. burnetii -abortusstorm heeft plaats gevonden. Om de melding gevoeliger te maken is in de loop van 2009 besloten om melkschapen- en melkgeitenbedrijven te monitoren op afwezigheid van de Q-koortsbacterie. Een daartoe ontwikkelde PCR op tankmelk is na validatie, in oktober 2009 als monitor van C. burnetii ingezet. Tot 2011 zijn op deze manier 64 bedrijven extra vastgesteld als ‘C. burnetii -besmet’. (19) In 2008 is bovendien gestart met de typering van Q-koortsmonsters van melkgeiten. In 90% van de monsters afkomstig van bedrijven in Noord-Brabant komt hetzelfde type C. burnetii voor. (19). Dit type dat overeenkomt met een genotype dat voorkomt in de humane uitbraak, speelt zeer waarschijnlijk een sleutelrol in de Q-koortsepidemie in Nederland.
Voorkomen in andere dieren en teken
De rol van kleine knaagdieren zoals ratten en muizen in de verspreiding van Q-koorts is onbekend. In een eerste inventariserend onderzoek zijn bij 15% van de ratten (met name de bruine rat) afkomstig van besmette bedrijven infecties met C. burnetii aangetoond (via serologie en via PCR van milt en fecesmateriaal). (20) Op dit moment loopt onderzoek naar het voorkomen van C. burnetii -infecties bij runderen, honden, katten en paarden.
Effectiviteit van veterinaire vaccinatie
Om uitscheiding van C. burnetii te voorkomen is er sinds 2009 een vaccinatieplicht voor ondermeer alle melkgeiten- en schapen. Onderzoek naar de effectiviteit van deze vaccinatie van melkgeiten en melkschapen leerde dat op gevaccineerde bedrijven veel minder besmette dieren werden aangetroffen, die ook nog een lagere besmettingsgraad hadden in vergelijking met niet gevaccineerde bedrijven. (21)
Effectiviteit van mestmaatregelen
Alhoewel mest niet overtuigend is aangetoond als verpreidingsfactor van C. burnetii , gelden er een aantal mestmaatregelen om verspreiding vanuit positieve bedrijven te voorkomen. Tot medio 2011 waren onder meer besmette bedrijven verplicht om de mest 150 dagen afgedekt op te slaan. Door onderzoek van het CVI (Central Veterinary Institute), de GD (Gezondheidsdienst voor Dieren) en het RIVM is vast komen te staan dat C. burnetti de warmtevorming bij deze compostering niet overleeft. In de schil van de mesthoop stijgt de temperatuur door compostering tot boven de 60 graden celsius gedurende 5 tot 12 dagen. De tijd die nodig is om het aantal bacteriën met een factor 10 te laten afnemen (de decimale reductietijd) bedraagt 180 seconden. (22)
Transmissie van Q-koorts
Aerogene verspreiding
Besmetting van de mens ontstaat door inhalatie van aerosolen. Stofdeeltjes afkomstig uit uitscheidingsproducten (placenta en vruchtwater) van geïnfecteerde dieren kunnen na indrogen nog lange tijd micro-organismen bevatten en aerogeen verspreid worden. Uit veterinair-humaan onderzoek is komen vast te staan dat verwaaiing van de bacterie vanuit besmette melkgeitenhouderijen als oorzaak van de epidemie in Nederland mag worden aangemerkt. (23, 24, 25)
Direct contact
Bij besmette vleesschapen werd dit risico van verwaaiing niet gezien, maar leidde direct contact met schapen en hun lammeren wel tot humane infecties. (26) Het is bekend dat omgevingsfactoren een rol spelen in de verspreiding omdat geografische analyses van lokale fysieke omgevingsfactoren rondom besmette bedrijven laten zien dat lage bodemvochtigheid en lage vegetatiedichtheid het risico op transmissie van de bacterie naar omwonenden verhoogt. (27) Momenteel wordt ook onderzocht welke bedrijfskenmerken en handelingen een rol spelen bij infecties van vee en de veehoudergezinnen op melkgeiten-, schapen- en melkrunderbedrijven.
Bloedtransfusie
Een beknopte publicatie uit 1977 meldt de transmissie vanC. burnetii via bloedtransfusie. (28) Sanquin heeft in 2009 een grote studie verricht naar de infectiedruk bij bloeddonors in Noord-Brabant. Er werd een aanzienlijke seroprevalentie en incidentie gevonden. Bij enkelen was C. burnetii -DNA (deoxyribonucleic acid) in het bloed aantoonbaar. Uit screening in 50 postcodegebieden met het hoogste meldingspercentage van Q-koorts bleek 1 op de 10 donoren kenmerken van een doorgemaakte Q-koortsinfectie te hebben. (29) In 2010 zijn bloeddonaties in het zelfde gebied, gescreend op aanwezigheid van C. burnetii- DNA, als onderdeel van de vrijgifte-procedure voor die donaties. Daarbij werden, in tegenstelling tot 2009, geen positieve donaties gevonden. (30)
Toekomstverwachting
Er zijn overtuigende epidemiologische aanwijzingen dat wellicht al sinds 2005, abortusgolven bij melkgeiten de bron zijn geweest van een grote hoeveelheid elkaar overlappende epidemieën. Genotypering van de bacterie laat zien dat 1 genotype verantwoordelijk is voor de verspreiding onder geiten (19), en dit zelfde genotype is ook aangetoond bij Nederlandse patiënten. (31) Omdat de incidentie van ziekte bij de mensen en geiten in 2010 sterk is afgenomen is het plausibel dat de combinatie van hygiënemaatregelen, vaccinaties en ruimingen effect hebben gehad. Het is nog onduidelijk waarom de epidemieën zich hebben voorgedaan. Het is aannemelijk dat daarbij sommige factoren belangrijk zijn geweest waaronder de lage seroprevalentie bij kleine herkauwers en daarmee de grote gevoeligheid in combinatie met de groei van de sector. Ook zal de snelle verspreiding van C. burnetii in en tussen de bedrijven via aerosolen en handel in dieren in belangrijke mate hebben meegespeeld aan het ontstaan van de epidemieën. Of bacterie-eigenschappen een rol van betekenis hebben gespeeld, of spelen is nog onbekend.
Dankzij de nieuwe gegevens over vaccineffectiviteit bij melkgeiten is het redelijk te verwachten dat we in 2012 een vergelijkbaar of nog lager aantal nieuwe Q-koortspatiënten zullen krijgen dan in 2011. De voorspelling moet nog steeds onder voorbehoud worden gemaakt, hoewel de droogste lente ooit (droog en warm weer vergemakkelijkt verspreiding) in 2011 geen seizoenspiek veroorzaakte.
Auteurs
Y.T.H.P. van Duynhoven (1), P.
Wever (2), F.
Dijkstra (1),
W. van der Hoek (1), H.J. Roest (3), C. Wijkmans
(4),
P. Vellema (5), T. Oomen (1), J.E. van Steenbergen
(1,6)
- Centrum Infectieziektebestrijding, RIVM, Bilthoven
- Jeroen Bosch Ziekenhuis, Den Bosch
- Centraal Veterinair Insituut, Lelystad
- GGD Hart voor Brabant
- Gezondheidsdienst voor Dieren, Deventer
- Centrum Infectieziekten, Leids Universitair Medisch Centrum
Correspondentie:
T. Oomen | ton.oomen@rivm.nl
Literatuur
- Richardus JH. Q-Koorts in Nederland: klinische, epidemiologische en immunologische aspekten [proefschrift]. Rotterdam: Technical University Delft, 1985. p.99
- Wijngaard CC van den, Dijkstra F, Pelt W van. In search of hidden Q-fever outbreaks: linking syndromic hospital clusters to infected goat farms. Epidemiol Infect. 2011 Jan;139(1):19-26. Epub 2010 May 18.
- van der Hoek W, Dijkstra F, Wijers N, et al. (2010). Drie jaar Q-koorts in Nederland: snellere diagnose. Nederlands Tijdschrift voor Geneeskunde, 154: A1845.
- Raoult D, Marrie
JT, and Mege JL. Natural history and pathophysiology of Q fever
The Lancet, April 2005, Pages 219-226 - Kampschreur LM, Wegdam-Blans MC (medisch centrum), Thijsen SF, et al. Acute Q fever related in-hospital mortality in the Netherlands. Neth J Med. 2010 Dec;68(12):408-13.
- Morroy G, Peters JB, Nieuwenhof M van, et al. The health status of Q-fever patients after long-term follow-up. BMC Infectious Diseases 2011, 11:97
- Limonard G, Nabuurs-Franssen M, Wijkmans C, et al. Serological surveillance and cardiac screening during prospective clinical follow-up of a large Q fever outbreak in the Netherlands. submitted, 2010.
- Dijkstra F, Riphagen-Dalhuisen J, Wijers N, et al. Antibiotic therapy for acute Q fever in The Netherlands in 2007 and 2008 and its relation to hospitalization. Epidemiol Infect 2010 Nov 19:1-10. [Epub ahead of print].
- Hoek W van der, Versteeg B, Meekelenkamp JC, et al. Follow-up of 686 Patients With Acute Q Fever and Detection of Chronic Infection. Clin Infect Dis.2011Jun;52(12):1431-6.
- van der Hoek W, Dijkstra F, Schimmer B, et al. Q fever in the Netherlands: an update on the epidemiology and control measures. Euro Surveill. 2010;15(12):pii=19520.
- Meekelenkamp JCE, Notermans DW, Rietveld A, et al. Seroprevalentie van Coxiella burnetii infecties bij zwangeren in Noord-Brabent 2007. Infect Bull 2009; 20:57-61.
- Munster et al. Cost-effectiveness of a screening strategy for Q fever among pregnant women in risk areas: a clustered randomized controlled trial. BMC Women’s Health 2010 10:32.
- Tilburg JJ, Melchers WJ, Pettersson AM, et al. Interlaboratory evaluation of different extraction and real-time PCR methods for the detection of Coxiella burnetii DNA in serum. J Clin Microbiol. 2010 Sep 8. [Epub ahead of print].
- Schneeberger PM, Hermans MHA (Master of Health Administration), van Hannen EJ, et al. Real-time PCR with serum samples is indispensable for early diagnosis of acute Q fever. Clin Vaccine Immunol 2010;17:286-90.
- Wegdam-Blans MCA (Medisch Centrum Alkmaar), Nabuurs-Franssen MH, Horrevorts AM, et al. Labarotoriumdiagnostiek van acute Q-koorts. Ned Tijdschr Geneeskd 2010;154:A2388.
- Wever PC, Arts CHP, Groot CAR (Calculation of Air Pollution from Road traffic), et al. Screening op chronische Q-koorts bij symptomatische patiënt met aneurysma of prothese van de aorta. Ned Tijdschr Geneeskd 2010;154:A2122.
- Bijlmer H. Consensus bij diagnostiek acute Q-koorts; waar zijn we het over eens? Infect Bull 2010; 9:323-325.
- Roest HI, Tilburg
JJ, et al.v (2010). The Q fever epidemic in
The Netherlands: history, onset, response and reflection. Epidemiol Infect: 1-12. - Roest HI, Ruuls RC, et al. (2009). Geografical distribution of MLVA (Multi-Locus Variable number of tandem repeat Analysis) types of Coxiella burnetii isolates from goats in the Netherlands. Medical Corps International Forum 4(supplement to MCIF 4/2009): 13.
- Reusken C, Plaats R van der, Opsteegh M,Bruin A de, Swart A. Coxiella burnetii (Q fever) in Rattus norvegicus and Rattus rattus at livestock farms and urban locations in the Netherlands; could Rattus spp (species). represent reservoirs for (re)introduction? Prev Vet Med. 2011;101(1-2):124-30. Epub 2011 Jun 2.
- Hogerwerf L, Brom R
van der, et al. Reduction of Coxiella burnetii Prevalence by
Vaccination of Goats and Sheep,
the Netherlands CDC (Centers for Disease Control and Prevention) EID (Tijdschrift Emerging Infectious Diseases) Volume 17, Number 3–March 2011 - Roest HIJJ, Dinkla
A, Rotterdam B van, et al. Overleving van Coxiella burnetii in
geitenmest – Eindrapportage
http://tinyurl.com/3kwl2cv - Karagiannis I, Schimmer B, Lier A van, et al. Investigation of a Q fever outbreak in a rural area of The Netherlands. Epidemiol. Infect., 137 (2009), pp. 1283–1294
- Schimmer B, Schegget ter R, Wegdam M, et al. The use of a geographic information system to identify a dairy goat farm as the most likely source of an urban Q-fever outbreak. BMC Infect. Dis., 10 (2010), p. 69
- Hackert V. The Goat Connection: een retrospectieve cohortstudie naar het verband tussen een geïdentificeerde veterinaire bron van Q-koorts en aansluitende humane gevallen. Infect. Bull. 2010, 03, 104-105
- Koene RP (Responsible Person), Schimmer B, Rensen, et al. A Q fever outbreak in a psychiatric care institution in the Netherlands. Epidemiol Infect.
- Hunink JE, Veenstra T, Hoek W van der, Droogers P. Q fever transmission to humans and local environmental conditions. 2010, FutureWater rapport 90. FutureWater, Wageningen.
- Canadian Diseases Weekly Report. 1977. Comment on Q fever transmitted by blood transfusion-United States. Can. Dis. Wkly. Rep. 3:210. (Editorial.)
- Velden RG van der, Dusseldorp A, et al. Q-koortsruimingen van besmette bedrijven. Evaluatieonderzoek onder geitenhouders. RIVM Rapport 609941001/2011
- Zaaijer HL, Hogema B, Schneeberger PM, et al. Q-fever among Dutch blood donors. Abstract 3B-S06-03. Vox Sanguinis 99. 2010.
- Zaaijer HL. Mondelinge mededeling over screening. 2010.