F.P.N. Mollema, J.H. Richardus, M. Behrendt, N Vaessen, W. Lodders, W. Hendriks, H.A. Verburgh, M.C. Vos
In deze prospectieve studie zijn de frequentie van en risicofactoren voor overdracht van MRSA (Methicilline-resistente Staphylococcus aureus) naar huisgenoten onderzocht (62 indexpersonen, 160 huisgenoten). In ongeveer de helft (29) van alle gevallen was sprake van MRSA-overdracht naar één of meer huisgenoten. MRSA-keeldragerschap, jonge leeftijd, eczeem en een lange periode van MRSA-expositie in de thuissituatie bleken significante risicofactoren terwijl wonden negatief geassocieerd bleken te zijn met MRSA-overdracht naar huisgenoten. Ook het hebben van een groot aantal huisgenoten en het hebben van een partner bleken significant geassocieerd te zijn met MRSA-overdracht. Er werd geen specifiek PFGE (pulsed-field gel electroforese)-type aangetoond, dat geassocieerd zou zijn met een grotere kans op MRSA-overdracht. Tot op dit moment is het afnemen van kweken bij huisgenoten en het behandelen van diegenen die MRSA-positief blijken te zijn, niet opgenomen in het search-and-destroybeleid. Wij adviseren dit wel te doen om verdere verspreiding van MRSA te verminderen.
Inleiding
MRSA is de meest voorkomende antibioticaresistente bacterie in ziekenhuizen in grote delen van de wereld. (1) Naast de ziekenhuisgerelateerde MRSA, is er ook aangetoond dat MRSA-dragerschap steeds meer buiten het ziekenhuis ontstaat (community acquired). In vergelijking met methicilline-gevoelige Staphylococcus aureus (MSSA (meticillinegevoelige S. aureus))-infecties, zijn MRSA-infecties moeilijker te behandelen en hebben zij vaker een ernstig beloop. (2, 3) MRSA-dragerschap speelt een belangrijke rol in de verspreiding van MRSA in zowel ziekenhuizen als daarbuiten. (4-6) Nederland heeft, als gevolg van het search-and-destroybeleid en het strikte antibioticabeleid, een lage MRSA-prevalentie. (1, 7, 8)
Door de stijging van het percentage community acquired MRSA-besmettingen is de epidemiologie van MRSA-dragerschap veranderd. (1) MRSA-overdracht van positieve personen naar hun huisgenoten en het effect daarvan op de verspreiding van MRSA, is een onderdeel van de problematiek dat nog onvoldoende is bestudeerd. Daarom is er nog geen evidencebasedbeleid over afgesproken en zijn huisgenoten van MRSA-positieve personen nog niet als risico groep in het search-and-destroy-beleid opgenomen. Het doel van dit onderzoek was om inzicht te krijgen in de frequentie van en risicofactoren voor MRSA-overdracht naar huisgenoten en de gevolgen ervan voor de gemeenschap.
Methoden en materialen
Gegevens verzameling
Alle nieuwe MRSA-positief gediagnosticeerde personen die, in de periode januari 2005-december 2007, waren opgenomen in het ziekenhuis, ofwel werden gezien op een polikliniek of werkzaam waren in het Erasmus Medisch Centrum Rotterdam of het Maasstad Ziekenhuis Rotterdam, werden uitgenodigd om deel te nemen aan het onderzoek. MRSA-positieve personen (vanaf hier indexpersonen genoemd) zonder huisgenoten werden niet in de studie meegenomen. Indien de indexpersoon huisgenoten had, werden er kweken van hen afgenomen, juist voordat de indexpersoon een MRSA-eradicatie behandeling zou krijgen, om te bepalen of er MRSA-overdracht was opgetreden.
Van alle indexpersonen en hun huisgenoten werd schriftelijke goedkeuring voor dit onderzoek gevraagd.
Definities
- Indexpersonen: patiënten of ziekenhuispersoneel waarbij een nieuw MRSA-dragerschap werd vastgesteld.
- Huisgenoten: personen die in hetzelfde huis leefden als de indexpersoon, of personen die meer dan 2 uur per dag in hetzelfde huis als de indexpersoon waren.
- MRSA-overdracht: een MRSA-positieve kweek van neus, keel, perineum of wonden dan wel huid laesies (indien die aanwezig waren) bij één van de huisgenoten gedurende de totale MRSA-expositie periode. Om MRSA-overdracht van de index persoon naar zijn/haar huisgenoot te bevestigen moest het PFGE patroon van de huisgenoten identiek aan die van de index persoon zijn.
- Basic reproductive ratio (R0): het totale aantal secundaire MRSA-positieve personen aan wie MRSA is overgedragen door de MRSA-positieve indexpersonen. Kortom, R0 = totale aantal MRSA-positieve huisgenoten / totale aantal MRSA-positieve indexpersonen. Omdat wij in deze studie naar de transmissie van MRSA onder huisgenoten, en derhalve dus de R0 in deze groep, hebben berekend zijn de MRSA-indexpersonen zonder huisgenoten niet in deze berekening meegenomen.
- Totale MRSA-expositieperiode: de periode tussen de eerste MRSA-positieve kweek van de index persoon en het moment dat de kweken van de huisgenoten van de indexpersoon werden afgenomen.
- MRSA-expositieperiode in de thuissituatie: de periode tussen vertrek uit het ziekenhuis en het moment dat er kweken van de huisgenoten van de indexpersoon werden afgenomen.
Vragenlijst
Gegevens over de mogelijke risicofactoren voor MRSA-overdracht van indexpersonen naar de huisgenoten werden verkregen door middel van een gestandaardiseerde vragenlijst. Deze vragenlijst bevatte onder andere vragen over het bestaan van huidproblemen of een niet intacte huid als gevolg van verwondingen of lichaamsvreemde materialen in de huid (zoals drains en katheters). Verder waren er vragen over de samenstelling van het huishouden, de verhouding tot de indexpersoon, leeftijd, geslacht en het aantal contacturen tussen de huisgenoten en de indexpersoon.
Microbiologie
Kweken werden afgenomen uit de keel, de voorzijde van beide neusgaten en het perineum. Indien er sprake was van een wond of een niet intacte huid werden daarvan gelijktijdig kweken afgenomen. De MRSA-kweekstokken werden in eerste instantie geïnoculeerd op bloedagarplaten (Becton Dickinson) en vervolgens werden de kweekstokken in een speciale, MRSA-specifieke, bouillon geplaatst. (9) De bloedagarplaten werden na 24 uur incubatie op 35 ºC , beoordeeld op bacteriegroei. Na 48 uur incubatie werd 1 ml van de bouillon op een bloedagarplaat aangebracht en deze werden na 24 uur incubatie op 35ºC opnieuw beoordeeld. Indien er minder dan 15 CFU aanwezig waren, werden er nieuwe kweken afgenomen. (10)
Alle MRSA-isolaten werden moleculair getypeerd met PFGE. Om de MRSA-overdracht van de indexpersonen naar zijn/haar huisgenoten te bevestigen, dienden de PFGE van indexpersoon en huisgenoot identiek te zijn. (11) Statistische analyses werden gedaan middels SPSS (Statisch computerprogramma) 15.0 voor Windows (SPSS, Inc. Chicago, IL).
Resultaten
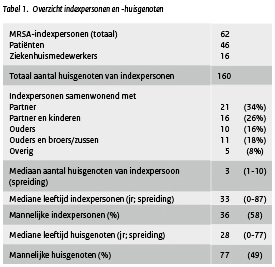
Aan dit onderzoek deden 62 nieuw gediagnosticeerde indexpersonen (46 patiënten en 16 ziekenhuis medewerkers) en hun 160 huisgenoten mee. Van de 62 indexpersonen, leefde 34% samen met een partner, 26% met een partner en kinderen, 16% met hun ouders, 18% met hun ouders en broers en/of zussen en 8% met andere huisgenoten. Het mediane aantal huisgenoten van de indexpersonen was 3. De mediane leeftijd van de indexpersonen was 33 jaar en meer dan de helft (58%) was man. De mediane leeftijd van de huisgenoten was 28 jaar en hiervan was ongeveer de helft (49%) man. (Tabel 1)
Tabel 1. Overzicht indexpersonen en -huisgenoten
MRSA-dragerschap en overdracht
Indexpersonen hadden een mediaan aantal
MRSA-positieve inventarisatiekweken van 2 (spreiding
van 1 tot 5 plaatsen). MRSA-dragerschap werd het
frequentst gevonden in de neus (87%; n=54), in de keel 68% (n=42)
en in het perineum 37% (n=23). Verder werd er bij 28 personen een
andere MRSA-positieve kweek gevonden (urine n=4,
wonden n=17, insteekopeningen van lichaamsvreemde materialen n=6,
overig n=1). Bij 33 (53%) van de 62 indexpersonen trad er geen
MRSA-overdracht op naar huisgenoten. Deze 33
indexpersonen hadden in totaal 76 huisgenoten. De 29 (47%)
indexpersonen die hun huisgenoten wel besmetten hadden in totaal 84
huisgenoten waarvan 56 MRSA-positief bleken. (R0=0.90)
Risicofactoren voor MRSA-overdracht
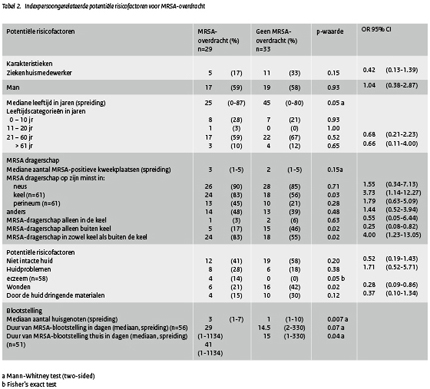
De aan de indexpersoon gerelateerde risicofactoren voor MRSA-overdracht naar hun huisgenoten staan in tabel 2. Indexpersonen die hun huisgenoten hadden besmet waren significant jonger dan de indexpersonen die dat niet hadden (25 jaar versus 45 jaar; p=0.05). Verder waren indexpersonen die hun huisgenoten hadden besmet op meer plaatsen MRSA-drager dan indexpersonen zonder MRSA-overdracht (3 versus 2 MRSA-positieve inventarisatiekweken; p=0.15). MRSA-dragerschap in de keel bleek significant geassocieerd te zijn met overdracht naar huisgenoten: 24 indexpersonen (83%) met overdracht waren keeldrager versus 18 indexpersonen (56%) zonder overdracht (p=0.03). Verder bleek dat MRSA-dragerschap in de keel in combinatie met één of meer andere MRSA-positieve plaatsen (bijvoorbeeld neus, perineum of andere locatie), het risico op MRSA-overdracht significant vergrootte (OR 4.00; 95% CI (Canadian Intense) 1.23-13.05 p=0.02). Indexpersonen met eczeem hadden een groter risico om hun huisgenoten te besmetten dan degenen zonder eczeem (p=0.05). De aanwezigheid van wonden bleek echter negatief geassocieerd met MRSA-overdracht. Indexpersonen die hun huisgenoten niet besmet hadden hadden een mediane totale expositieperiode van 15 dagen. In de groep met MRSA-overdracht was dit 29 dagen. De duur van de MRSA-expositieperiode in de thuissituatie was significant geassocieerd met de overdracht van indexpersonen op hun huisgenoten (41 dagen versus 15 dagen voor indexpersonen zonder MRSA-overdracht; p=0.04).
Huisgenoten van MRSA-indexpersonen
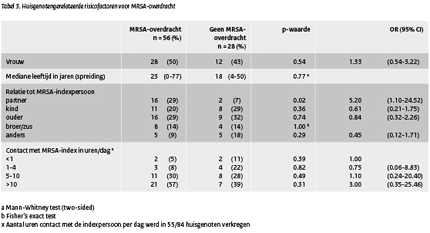
De aan de huisgenoten gerelateerde risico factoren voor MRSA-overdracht staan in tabel 3. Indexpersonen die hun huisgenoten besmet hadden , leefden in grotere huishoudens dan de degenen zonder MRSA-overdracht (3 versus 1 huisgenoot; p=0.007). Van de indexpersonen die hun huisgenoten besmet hadden had 83% minimaal 2 huisgenoten versus 49% van de indexpersonen zonder MRSA-overdracht ( OR 5.100; 95% CI 1.57-16.61; p=0.005).
Partners van indexpersonen bleken, in geval van overdracht, de grootste kans te lopen om MRSA-drager te worden (OR 5.20; 95% CI 1.10-24.52; p=0.02). Het aantal contacturen per dag tussen een huisgenoot en een MRSA-positieve indexpersoon bleek niet geassocieerd te zijn met een verhoogd risico op MRSA-overdracht.
PFGE-type en overdracht
PFGE-types van MRSA-isolaten van indexpersonen en hun MRSA-positieve huisgenoten werden met elkaar vergeleken om te bepalen of er overdracht had plaatsgevonden. Er werden 30 verschillende PFGE-patronen geïdentificeerd in de 62 indexpersonen. De 29 indexpersonen die hun MRSA naar één of meer huisgenoten hadden overgedragen, hadden 20 genotypisch verschillende MRSA-stammen. Er bleek geen dominant PFGE-type te zijn dat meer MRSA-overdracht naar huisgenoten veroorzaakte.
Discussie
MRSA-overdracht van indexpersonen naar huisgenoten is in verschillende onderzoeken eerder aangetoond. Toch zijn de resultaten moeilijk met elkaar te vergelijken omdat de onderzoeksmethoden in vergelijking met eerdere onderzoeken erg verschillend zijn. (12-19) Met dit onderzoek hebben wij verschillende risicofactoren voor MRSA-overdracht van een indexpersoon naar zijn/haar huisgenoten aangetoond:
- MRSA-keeldragerschap vergroot significant het risico op MRSA-overdracht. Uit voorgaand onderzoek is gebleken dat bijvoorbeeld sputum of neusvocht de oorzaak kunnen zijn van MRSA-overdracht naar de omgeving. (5, 20, 21) Dit suggereert dat MRSA-overdracht kan worden veroorzaakt door de verspreiding van MRSA uit de keel door hoesten, niezen of zoenen. In eerdere onderzoeken naar MRSA-overdracht van indexpersonen naar hun huisgenoten, werden geen keel kweken afgenomen. (14-16, 18) Een groot percentage van de indexpersonen (68%) in ons onderzoek was MRSA-keeldrager hetgeen impliceert dat het noodzakelijk is om de keelkweken af te nemen. (22, 23)
- Een lange MRSA-expositieperiode in de thuissituatie, vergroot het risico op MRSA-overdracht van indexpersonen naar huisgenoten. Huisgenoten van MRSA-positief ziekenhuispersoneel zijn korter blootgesteld aan besmetting dan huisgenoten van MRSA-positieve patiënten omdat ziekenhuispersoneel onmiddellijk na vaststelling van MRSA-dragerschap behandeld wordt.
- Indexpersonen die MRSA hebben overgedragen naar hun huisgenoten, hebben gemiddeld een groter aantal huisgenoten dan indexpersonen zonder overdracht. Ook is in voorgaande onderzoeken aangetoond dat de aanwezigheid van veel mensen in een klein huis of kleine ruimte het risico van overdracht vergroot.(12, 13, 19)
- Indexpersonen met eczeem bleken een groter risico te hebben om MRSA aan hun huisgenoten over te dragen. Een verklaring hiervoor kan zijn dat eczeemplekken vaak niet bedekt worden. Het blijkt dat wonden, die wel bedekt zijn, juist minder risico op MRSA-overdracht geven.
- Indexpersonen met MRSA-overdracht naar huisgenoten bleken een significant lagere leeftijd te hebben dan indexpersonen zonder MRSA-overdracht. Dit kan niet geheel worden verklaard, (12, 13) maar is mogelijk geassocieerd met het feit dat jongere mensen meer anderen in de directe omgeving hebben dan oudere mensen.
- Partners van MRSA-indexpersonen lopen een groter risico om MRSA-drager te worden door het intensiever lichamelijk contact. (24)
- In Nederland is de MRSA-prevalentie één van de laagste ter wereld is (1), waardoor het mogelijk is dat het percentage MRSA-overdracht niet representatief is voor landen waar de MRSA-prevalentie hoger is.
- Omdat wij in ons onderzoek zeer veel verschillende PFGE-typen hebben aangetoond en omdat er een zeer lage prevalentie community-acquired MRSA voorkomt, kunnen wij met grote zekerheid stellen dat de huisgenoten die MRSA-positief zijn bevonden, dit van de indexpersoon overgedragen hebben gekregen en dat zij deze niet ergens anders in de gemeenschap hebben opgelopen.
- In dit onderzoek hebben wij geen informatie ingewonnen over het recente antibioticagebruik van de indexpersonen of hun huisgenoten. Als gevolg hiervan kan er niet met zekerheid gesteld worden dat dit geen invloed heeft gehad op de onderzoeksresultaten.
- In verschillende onderzoeken in het verleden is aangetoond dat er in de omgeving (bijvoorbeeld de ziekenhuiskamer) van een MRSA-positieve patiënt, MRSA kan worden aangetoond. (5, 21) Het is dus aannemelijk dat dit bij MRSA-overdracht in een thuissituatie ook voorkomt. In dat geval heeft de indexpersoon eerst de omgeving (bijvoorbeeld meubelen, handdoeken etc.) besmet en als gevolg daarvan is de omgeving de bron van besmetting voor de huisgenoten geweest. In ons onderzoek hebben wij geen monsters van de omgeving afgenomen om te onderzoeken of de omgeving inderdaad als vector voor MRSA-overdracht heeft gediend.
MRSA-overdracht tussen familieleden of huisgenoten roept een aantal belangrijke vragen op, onder andere of er bij huisgenoten van indexpersonen regelmatig MRSA-inventarisatiekweken moeten worden afgenomen om zo positieve huisgenoten ook een MRSA-eradicatiebehandeling aan te bieden. Indien MRSA-positieve huisgenoten niet worden herkend kunnen zij ongemerkt MRSA introduceren in de gemeenschap. Verder kunnen zij de oorzaak zijn van hernieuwde MRSA-positiviteit van een indexpersoon die daardoor ook een bron wordt van MRSA-verspreiding in de gemeenschap. Ondanks dat de R0 1, kan dit mogelijk wel zorgen voor de verspreiding van MRSA in specifieke groepen of populaties rondom de indexpersoon of huisgenoten. (25, 26)
Tot op heden is het inventariseren van huisgenoten van indexpersonen, en het gelijktijdig behandelen van de huisgenoten die MRSA-positief zijn bevonden, nog niet opgenomen in het search-and-destroybeleid in Nederland of waar ook ter wereld. Wij adviseren om beide maatregelen in het beleid te implementeren omdat dit kan bijdragen aan het inperken van verspreiding van MRSA in de samenleving.
Auteurs
F.P.N. Mollema (1), J.H.
Richardus (2), M. Behrendt (1), N.Vaessen (1),
W. Lodders (3), W. Hendriks (3), H.A. Verbrugh (1), M.C. Vos
(1)
- Erasmus Universitair Medisch Centrum, afdeling Medische microbiologie en infectieziekten, Rotterdam
- Erasmus Universitair Medisch Centrum, afdeling Maatschappelijke gezondheid, Rotterdam
- Maasstad Ziekenhuis, Rotterdam
Correspondentie:
F.P.N. Mollema| f.mollema@erasmusmc.nl
Dit artikel is gebaseerd op: Transmission of Methicillin-Resistant Staphylococcus aureus to Household Contacts Journal of Clinical Microbiology 2010, vol 48, 1, p 202-207
Dit onderzoek werd gefinancierd door het Erasmus Universitair Medisch Centrum Rotterdam. De auteurs danken dr. A. Ott (Infectieziekten Laboratorium Groningen) voor zijn bijdrage aan de studieopzet.
Transmission of Methicillin-Resistant Staphylococcus aureus to Household Contacts
The frequency and risk factors for MRSA transmission of a MRSA index person to household contacts were assessed in this prospective study (62 newly diagnosed index persons and their 160 household contacts). Transmission of MRSA from an index person to household contacts occurred in nearly half of the cases (47%; n=29). Significant risk factors for MRSA transmission to household contacts were prolonged MRSA exposure time to MRSA at home, MRSA colonization at least in the throat, younger age and eczema in index persons; the presence of wounds being negatively associated. Furthermore, an increased number of household contacts and being the partner of an MRSA index person were household related risk factors for MRSA acquisition of the index person. No predominant PFGE type was observed which transmitted more frequently compared to other PFGE types. We suggest to include in MRSA prevention guidelines the screening of household contacts and, to those found positive, providing MRSA eradication therapy simultaneously with the index person as this may reduce further spread of MRSA.
Literatuur
- European Antimicrobial Resistance Surveillance System (EARSS (European Antimicrobial Resistance Surveillance System)). Annual Report EARSS-2006. Bilthoven, the Netherlands: RIVM, 2007. http://www.earss.rivm.nl
- Blot SI, Vandewoude KH, Hoste EA and Colardyn FA. Outcome and attributable mortality in critically Ill patients with bacteremia involving methicillin-susceptible and methicillin-resistant Staphylococcus aureus. Arch Intern Med 2002;162:2229-35
- Cosgrove SE, Sakoulas G, Perencevich EN, Schwaber MJ, Karchmer AW and Carmeli Y. Comparison of mortality associated with methicillin-resistant and methicillin-susceptible Staphylococcus aureus bacteremia: a meta-analysis. Clin Infect Dis 2003;36:53-9
- Boyce JM (Joint meeting). Methicillin-resistant Staphylococcus aureus. Detection, epidemiology, and control measures. Infect Dis Clin North Am 1989;3:901-13
- Boyce JM, Potter-Bynoe G, Chenevert C and King T. Environmental contamination due to methicillin-resistant Staphylococcus aureus: possible infection control implications. Infect Control Hosp Epidemiol 1997;18:622-7
- Casewell MW, Hill RL (richtlijn). Elimination of nasal carriage of Staphylococcus aureus with mupirocin (‘pseudomonic acid’)--a controlled trial. J Antimicrob Chemother 1986;17:365-72
- Vos MC (medisch centrum), Behrendt MD, Melles DC, Mollema FPN, de Groot W, Parlevliet G, Ott A, Horst-Kreft D, van Belkum A, Verbrugh HA. MRSA Search and Destroy policy: 5-year experience in the largest University Medical Center of The Netherlands. Infect Control and Hosp Epidemiol 2009;30:977-984
- Wertheim HF, Vos MC, Boelens HA, et al. Low prevalence of methicillin-resistant Staphylococcus aureus (MRSA) at hospital admission in the Netherlands: the value of search and destroy and restrictive antibiotic use. J Hosp Infect 2004;56:321-5
- Wertheim H, Verbrugh HA, van Pelt C, de Man P, van Belkum A and Vos MC. Improved detection of methicillin-resistant Staphylococcus aureus using phenyl mannitol broth containing aztreonam and ceftizoxime. J Clin Microbiol 2001;39:2660-2
- Kerremans JJ, Maaskant J, Verbrugh HA, van Leeuwen WB and Vos MC. Detection of methicillin-resistant Staphylococcus aureus in a low-prevalence setting by polymerase chain reaction with a selective enrichment broth. Diagn Microbiol Infect Dis 2008;61:396-401
- Tenover FC, Arbeit RD (RijksDriehoek), Goering RV, et al. Interpreting chromosomal DNA (deoxyribonucleic acid) restriction patterns produced by pulsed-field gel electrophoresis: criteria for bacterial strain typing. J Clin Microbiol 1995;33:2233-9
- Calfee DP, Durbin LJ, Germanson TP, Toney DM (dystrophia myotonica), Smith EB and Farr BM. Spread of methicillin-resistant Staphylococcus aureus (MRSA) among household contacts of individuals with nosocomially acquired MRSA. Infect Control Hosp Epidemiol 2003;24:422-6
- Johansson PJ, Gustafsson EB and Ringberg H. High prevalence of MRSA in household contacts. Scand J Infect Dis 2007;39:764-8
- Eveillard M, Martin Y, Hidri N, Boussougant Y and Joly-Guillou ML. Carriage of methicillin-resistant Staphylococcus aureus among hospital employees: prevalence, duration, and transmission to households. Infect Control Hosp Epidemiol 2004;25:114-20
- Ho PL, Cheung C, Mak GC, et al. Molecular epidemiology and household transmission of community-associated methicillin-resistant Staphylococcus aureus in Hong Kong. Diagn Microbiol Infect Dis 2007;57:145-51
- Lu PL, Tsai JC, Chiu YW, et al. Methicillin-resistant Staphylococcus aureus carriage, infection and transmission in dialysis patients, healthcare workers and their family members. Nephrol Dial Transplant 2008;23:1659-65
- Lucet JC, Paoletti X, Demontpion C, et al. Carriage of methicillin-resistant Staphylococcus aureus in home care settings: prevalence, duration, and transmission to household members. Arch Intern Med 2009;169:1372-8
- Zafar U, Johnson LB, Hanna M, et al. Prevalence of nasal colonization among patients with community-associated methicillin-resistant Staphylococcus aureus infection and their household contacts. Infect Control Hosp Epidemiol 2007;28:966-9
- Hall AJ, Bixler D and Haddy LE. Multiclonal outbreak of methicillin-resistant Staphylococcus aureus infections on a collegiate football team. Epidemiol Infect 2008:1-9
- Snyder GM, Thom KA, Furuno JP, et al. Detection of methicillin-resistant Staphylococcus aureus and vancomycin-resistant enterococci on the gowns and gloves of healthcare workers. Infect Control Hosp Epidemiol 2008;29:583-9
- Rohr U, Kaminski A, Wilhelm M, Jurzik L, Gatermann S and Muhr G. Colonization of patients and contamination of the patients’ environment by MRSA under conditions of single-room isolation. Int J Hyg Environ Health 2008
- Mertz D, Frei R, Jaussi B, et al. Throat swabs are necessary to reliably detect carriers of Staphylococcus aureus. Clin Infect Dis 2007;45:475-7
- Widmer AF, Mertz D and Frei R. Necessity of screening of both the nose and the throat to detect methicillin-resistant Staphylococcus aureus colonization in patients upon admission to an intensive care unit. J Clin Microbiol 2008;46:835
- Centers for Disease Control and Prevention. Methicillin-resistant Staphylococcus aureus among players on a high school football team--New York City, 2007. MMWR (Morbidity and Mortality Weekly Report) Morb Mortal Wkly Rep 2009;58:52-5
- Kazakova SV, Hageman JC, Matava M, et al. A clone of methicillin-resistant Staphylococcus aureus among professional football players. N Engl J Med 2005;352:468-75