F. Groenendijk-Beijersbergen van Henegouwen, E. Van Dijk
In de provincie Zeeland was in 2010 sprake van een cluster van infecties met het hepatitis A-virus. Uit bron- en contactonderzoek, ondersteund door laboratoriumdiagnostiek, bleek dat de transmissie met name via direct oro-anaal contact heeft plaatsgevonden. De belangrijkste risicogroep vormen mannen die seks hebben met mannen (MSM (mannen die seks hebben met mannen)), en vaak risico lopen door anonieme sekscontacten.
In de periode juni-september 2010 werden bij GGD (Gemeentelijke Gezondheidsdienst) Zeeland 22 personen gemeld met een recent opgelopen hepatitis A-infectie. Hiermee is het incidentiecijfer 5,7 per 100.000 inwoners en daarmee ruim 5 keer hoger dan het landelijke gemiddelde van 1,1 per 100.000 inwoners. Normaal ligt het incidentiecijfer voor de provincie Zeeland op 0,5 per 100.000 inwoners. Uit bron- en contact onderzoek en nadere typering van de verwekker is vast komen te staan dat er sprake was van een cluster onder de risicogroep van MSM. Daarnaast werden 2 solitaire gevallen gemeld die geen verband bleken te hebben met dit cluster.
Op zich is een uitbraak van HAV (Hepatitis A virus)-infectie onder MSM niet ongewoon. In het verleden is dit vaker gezien zoals in Denemarken (Kopenhagen), Zweden (Stockholm), Spanje (Barcelona) en Nederland (Amsterdam). (1-3) Bijzonder is nu dat verspreiding van het virus in deze grote omvang voorkomt buiten een grootstedelijk gebied en voor de tweede keer in Nederland. In dit veldbericht wordt aandacht besteed aan de verschijnselen en transmissieroute van HAV, diagnostiek, beschrijving van het cluster, door GGD genomen maatregelen en aandachtspunten voor de praktijk.
Achtergrondinformatie bij hepatitis A
Verschijnselen
Een infectie met HAV verloopt bij (jonge) kinderen vaak onopgemerkt, maar bij volwassenen treden meestal wel verschijnselen op. Er is dan een plotseling begin met algehele malaise, griep, koorts, gebrek aan eetlust, misselijkheid en buikklachten. Na enkele dagen kunnen icterus, donkere urine en soms stopverfkleurige feces ontstaan. De duur en ernst van de ziekte nemen in het algemeen toe met de leeftijd. Complicaties van HAV-infecties zijn geprolongeerde cholestatische hepatitis met heftige jeuk en relapsing hepatitis. Bij 6-10% van de patiënten ontstaat bifasische hepatitis A, waarbij na aanvankelijk herstel opnieuw een langdurige cholestatische periode ontstaat. Een fulminante hepatitis doet zich in minder dan 1,5% van de gevallen voor. Een HAV-infectie wordt nooit chronisch. Alle patiënten met een ongecompliceerde HAV-infectie genezen uiteindelijk zonder restverschijnselen.
Transmissieroute, ook oro-anaal!
Het maag-darmkanaal van de mens is het reservoir voor HAV. Transmissie verloopt daardoor vaak via ongewassen en/ of ongekookt voedsel of via verontreinigd water. Garnalen en vooral schelpdieren, die grote hoeveelheden water filteren en zich aldus voeden met organisch materiaal, zijn in dat opzicht ook berucht als besmettingsbron. Infecties langs deze indirecte transmissieweg worden meestal opgedaan in het buitenland, met name buiten Europa. Naast indirecte besmetting kan transmissie ook optreden via direct oro-anaal contact. Dit wordt vooral gezien onder mannen die seks hebben met mannen (MSM), bij wie ‘rimmen’ (likken van de anale regio) een vaak geconstateerde transmissieroute is.
Diagnostiek
De diagnose van een recente HAV-infectie berust op de detectie van specifieke IgM (immuunglobuline M)- antistoffen in het serum. Het serologisch aantonen van IgG (Immunoglobulin G)-antistoffen wijst op een doorgemaakt infectie in het verleden of op een succesvol afgeronde vaccinatieserie. Serum dat positief is voor HAV-specifieke IgM-antistoffen kan, na overleg, voor moleculaire typering worden ingestuurd naar het RIVM.
Door GGD Amsterdam is in 2009 een onderzoek gepubliceerd naar genotypering van HAV. Bij MSM werd het genotype 1A aangetoond en bij de migrantenkinderen/ reizigersgroep werd het genotype 1B aangetoond. (4) Uit aanvullend Amsterdams onderzoek bleek dat er 2 belangrijke risicogroepen zijn, namelijk reizigers en hun contacten en MSM en hun contacten. De groepen konden op basis van de genotypering worden ingedeeld. De clusters onder de reizigers zijn klein en zijn overwegend seizoensgebonden in tegenstelling tot de clusters onder MSM. Deze zijn groter en kunnen het gehele jaar voorkomen. (5)
Beschrijving van het cluster
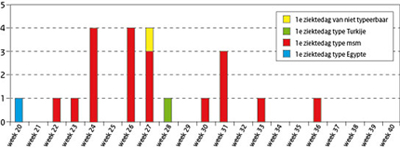
In de periode juni-september 2010 werden uiteindelijk 22 patiënten gemeld bij de GGD Zeeland, waarvan de laatste melding op 15 september binnen kwam. Op 1 juni kreeg GGD Zeeland via het laboratorium de eerste melding binnen van een HAV-infectie. Sequentieanalyse door het RIVM toonde aan dat het ging om de stam 1B-Egypte. Kort daarna werden er meerdere gevallen van HAV-infecties gemeld. De eerste ziektedagen daarvan lagen dicht bij elkaar. Sequentieanalyse toonde bij deze gevallen een type 1A-stam aan. Het gaat hierbij om een specifieke 1A-stam die sinds de zomer van 2008 in Europa voorkomt bij MSM. Uit bron- en contactonderzoek kwam, in aansluiting met de laboratoriumdiagnostiek, naar voren dat de transmissie met name via direct oro-anaal contact had plaatsgevonden. Zeeuwse MSM lopen risico via sekscontacten in uitgaansgelegenheden voor MSM in België en via anonieme ontmoetingsplaatsen in de buitenlucht (‘banen’). Later op het epidemiologische tijdspad kwam een melding binnen van een solitair geval van type 1B-Turkije. Eén ander geval, ook de 1A-stam werd gemeld na sequentieanalyse door het Toezicht Volksgezondheid Oost-Vlaanderen. De reden hiervan is, dat de betreffende persoon in België woont. (Figuur 1)
Figuur 1 Het epidemiologische beloop van de bij GGD Zeeland gemelde casussen met HAV tussen juni en september 2010
Maatregelen om verdere verspreiding te voorkomen
Naar aanleiding van de meldingen zette de GGD Zeeland bron- en contact onderzoek in. Contacten van patiënten werden serologisch gescreend. Zij kregen vaccinatie aangeboden of, indien nodig, immunoglobuline. Naar aanleiding van het aantal gemelde gevallen van HAV-infecties werd een intern outbreakteam (OBT) samengesteld met daarin een arts IZB (Infectieziektebestrijding), verpleegkundige IZB, een soaverpleegkundige, een communicatieadviseur en secretarieel medewerker.
Uit bron- en contactonderzoek kwam naar voren dat bij 2 gevallen een duidelijke link bestond met (indirecte) besmetting in Egypte en Turkije en dat de andere gevallen waarschijnlijk gerelateerd waren aan (directe) besmetting in het circuit van MSM. De besmette personen wonen verspreid in de provincie. De voornaamste bron van het cluster lijkt de (vaak anonieme) sekscontacten in uitgaansgelegenheden en ontmoetingsplaatsen voor MSM te zijn. Gezien het feit dat een aantal gelegenheden in België (Gent, Antwerpen) zijn gelokaliseerd, werd de Belgische gezondheidsdienst (FOD (federale onderzoeks dienst)) ingelicht. In België werd geen verheffing gezien. Ook werden de huisartsen en internisten van de provincie Zeeland ingelicht. De behandelaars werden gewezen op de mogelijkheid van vaccinatie tegen HAV voor deze risicogroep. MSM werden geïnformeerd via internet (www.gaysite.nl), de gaykrant, de belangenvereniging COC en via sociaal verpleegkundigen, die folders uitdeelden bij de ontmoetingsplaatsen. De reisbureaus kregen een informatiebrief en er was aandacht voor het HAV-cluster tijdens het reizigersspreekuur van de GGD. De algemene bevolking werd ingelicht via de GGD-website en de Zeeuwse media. Opvallend was dat er weinig tot geen onrust ontstond onder de Zeeuwse bevolking.
Ten aanzien van de transmissie van HAV wordt in de praktijk primair gedacht aan de indirecte route (voedsel/ water). Het is uitzonderlijk dat in Nederland op deze grote schaal HAV circuleerde onder MSM, waarbij de transmissieroute plaatsvond via seksueel contact. Het is ook uniek dat dit cluster zich bevond buiten een grootstedelijk gebied.
Conclusie
Omdat er weer een cluster van HAV-infecties was, nu buiten de grote steden, lijkt het erop datHAV-infecties een terugkerend probleem is onder MSM in Nederland. Het is daarom zinvol om MSM te benaderen met gerichte preventieve maatregelen en hen ook buiten clusters om een vaccinatieserie tegen HAV aan te bieden. Op dit moment wordt in Nederland al vaccinatie van hepatitis B aangeboden aan risicogroepen, waaronder MSM.
Dit signaal onderstreept het belang van het aanbieden van het combinatievaccin van hepatitis A en B aan deze risicogroep, in aansluiting op het reeds bestaande preventieprogramma.
Deskundigheidsbevordering van huisartsen en specialisten (internisten) lijkt nodig, omdat tijdens het cluster bleek dat deze professionals vaak niet bekend waren met een seksuele transmissieroute van hepatitis A. GGD Zeeland inventariseert de mogelijkheden om dit verder op te pakken.
Auteurs
F. Groenendijk-Beijersbergen van Henegouwen, E. Van Dijk,
GGD Zeeland
Correspondentie:
F. Groenendijk-Beijersbergen van Henegouwen |
Fleur.Groenendijk@ggdzeeland.nl
Literatuur
1. Mazick A, Howitz M, Rex S, Jensen IP, Weis N, Katzenstein TL, Haff J, Molbak K. Hepatis A outbreak among MSM linked to casual sex and gay saunas in Copenhagen, Denmark. Euro Surveill 2005; 10 (5): 111-114
2. Urbanus AT, Houdt R van, Laar TJW van de, Coutinho RA. Viral hepatitis among men who have sex with men, epidemiology and public health consequences. Euro Surveill. 2009; 14 (47): pii=19421
3. Tortajada C, Olalla PG de, Pinto RM (risicomanagement), Cayla J. Outbreak of hepatitis A among men who have sex with men in Barcelona, Spain, September 2008- March 2009. Euro Surveill 2009; 14(15): pii=19175
4. Tjon GMS, Steenbergen JE van, Hoek JAR van den, Koek A, Coutinho RA, Bruisten SM. Two Years’ prospective collection of molecular and epidemiological data shows limited spread of hepatitis A virus outside risk groups in Amsterdam, 2000-2002. Journal of Infectious Deseases 2004; 189: 471-482
5. Tjon GMS, Xiridou M, Coutinho RA, Bruisten SM. Different transmission patterns of hepatitis A virus for two main risk groups as evidenced by molecular cluster analysis. Journal of Medical Virology 2007; 79 (5): 488-494