A. van der Ende, L. Spanjaard
Bacteriële meningitis is een ernstige infectie van de membranen die de hersenen en ruggemerg omgeven met een hoge mortaliteit en morbiditeit ondanks optimale antimicrobiële therapie. In Nederland wordt de surveillance door het Nederlands Referentielaboratorium voor Bacteriële Meningitis (NRLBM (Nederlands Referentie Laboratorium voor Bacteriële Meningitis)) uitgevoerd. Dit laboratorium had in 1958 een onofficiële start. In dat jaar werd door de toenmalige hoogleraar Bacteriologie, Epidemiologie en Immuniteitsleer, Charlotte Ruys, begonnen met de karakterisering van meningokokkenisolaten die uit het hele land werden verzameld. In 1978 werd het NRLBM een officieel samenwerkingsverband tussen het RIVM en de Universiteit van Amsterdam.
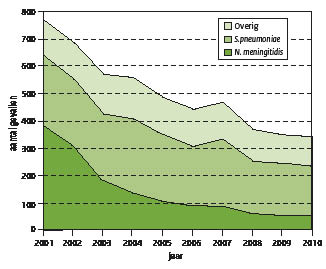
De afgelopen 10 jaar is de incidentie van bacteriële meningitis met meer dan 50% gedaald. In 2001 ontving het NRLBM van 772 patiënten het isolaat uit de liquor en in 2010 was dit aantal gedaald tot 340 patiënten. (Figuur 1) Het werkelijk aantal patiënten met bacteriële meningitis is ongeveer 10% tot 15% hoger. Hiervoor zijn twee redenen. Bij ongeveer 10% van de patiënten was de liquor negatief in de kweek, maar positief in een PCR (polymerase chain reaction) specifiek voor pneumokokken of meningokokken. Verder bleek uit een in 2007 gehouden enquête onder inzendende laboratoria dat deze 90% van de meningokokken- en peumokokkenisolaten uit liquor zenden naar het NRLBM en 83% van de overige isolaten; dit komt neer op een overall dekkingspercentage van 88%.
De proportie onder de ingezonden liquorisolaten van de twee belangrijkste verwekkers van bacteriële meningitis, Neisseria meningitidis en Streptococcus pneumoniae, was 51% respectievelijk 32% in 2001 en 16% respectievelijk 52% in 2010. De daling van de incidentie van bacteriële meningitis wordt dus voornamelijk veroorzaakt door een afname van meningokokken meningitis met als gevolg dat sinds 2003 S. pneumoniae de meest voorkomende verwekker van bacteriële meningitis is. Bacteriële meningitis door andere verwekkers dan de meningokok en de pneumokok is de afgelopen 10 jaar proportioneel toegenomen, maar absoluut vrijwel constant gebleven. (Figuur 1) Onder de 17% (134 in 2001) tot 32% (111 in 2010) overige verwekkers bevinden zich meer dan 7 soorten, waarvan Streptococcus agalactiae, Listeria monocytogenes, Escherichia coli en Staphylococcus aureus de belangrijkste zijn.
De daling van de incidentie is het grootst onder kinderen jonger dan 5 jaar. (Figuur 2) Onder personen ouder dan 30 jaar is de incidentie van bacteriële meningitis de afgelopen 10 jaar vrijwel onveranderd gebleven.
Figuur 1: aantal gevallen van bacteriële meningitis, 2001-2010
Figuur 2: Aantal gevallen van bacteriële meningitis naar leeftijd, 2001-2010
Neisseria meningitidis
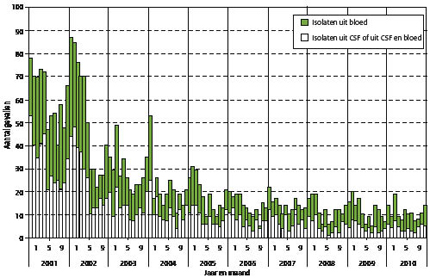
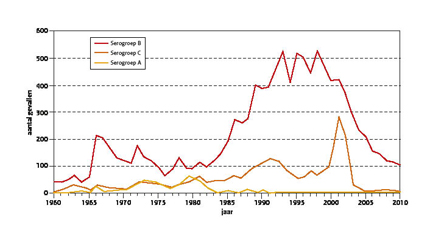
Sinds 2001 is het aantal gevallen van invasieve meningokokkenziekte dramatisch gedaald van 717 gevallen in 2001 tot 132 in 2010, waarbij de invloed van de seizoenen op het aantal gevallen steeds minder duidelijk wordt. (Figuur 3) Nadat in 2001 de incidentie van meningokokkenziekte plotseling toenam, door een toename van het aantal gevallen van serogroep C-meningokokkenziekte, (figuur 4) werd in 2002 besloten vaccinatie tegen serogroep C-meningokokken in te voeren in het Rijksvaccinatieprogramma door alle kinderen op de leeftijd van 14 maanden eenmalig te vaccineren. Daarnaast is een inhaalprogramma uitgevoerd waarbij alle kinderen van 14 maanden tot 19 jaar werden gevaccineerd. Direct na de invoering van het vaccinatieprogramma daalde de incidentie van serogroep C-meningokokkenziekte dramatisch. (Figuur 4) Waren er in 2001 nog 276 gevallen, in 2005 was dit teruggelopen tot nog maar 4 gevallen (alle bij niet-gevaccineerden) en dit bleef in de daarop volgende jaren laag. Tot op heden zijn 3 gevallen met vaccinfalen waargenomen; 2 van deze personen hadden een immuundeficiëntie. De daling van de incidentie van serogroep C-meningokokkenziekte trad niet alleen op onder gevaccineerde personen, maar ook onder niet-gevaccineerden. Dit zou op groepsprotectie kunnen wijzen, al kan niet worden uitgesloten dat een natuurlijk verloop in het vóórkomen van serogroep C-meningokokkenziekte hiertoe heeft bijgedragen.
Figuur 3: Aantal gevallen van invasieve meningokokkenziekte per maand 2001-2010
Figuur 4: Aantal gevallen van meningokokkenziekte naar serogroep, 1960-2010
De daling van de incidentie van meningokokkenziekte is niet alleen aan vaccinatie tegen serogroep C-meningokokken toe te schrijven. Nadat sinds het begin van de jaren ’80 van de vorige eeuw de incidentie van serogroep B-meningokokkenziekte toenam, voornamelijk door de opkomst van de hypervirulente kloon cc41/44 (1), nam deze sinds eind jaren ’90 van de vorige eeuw weer geleidelijk af. (Figuur 4) Een zekere verklaring hiervoor is er niet, maar waarschijnlijk is de immuniteit tegen meningokokken behorende tot de hypervirulente kloon cc41/44 onder de bevolking zodanig toegenomen dat deze kloon zich niet langer in de populatie kan handhaven. Aanwijzing hiervoor zou kunnen zijn dat de variatie onder de cc41/44-meningokokken nu groter is dan in de jaren ‘80 en ’90 van de vorige eeuw. De dalende incidentie van serogroep B-meningokokkenziekte betekent niet dat de last van meningokokkenziekte spontaan verwaarloosbaar zal worden. Verheffingen van serogroep B-meningokokkenziekte komen regelmatig voor met tussenpozen van 10 tot 25 jaar. Bovendien zijn er jaarlijks toch nog ongeveer 130 gevallen van serogroep B-meningokokkenziekte waardoor gemiddeld 10 patiënten overlijden en 15 neurologische restverschijnselen houden. (2) Een vaccin tegen serogroep B-meningokokken is dan ook gewenst. Het ligt voor de hand hierbij een soortgelijke strategie toe te passen als zo succesvol is toegepast voor het vaccin tegen serogroep C-meningokokken. Het kapselpolysacharide van serogroep B-meningokokken is echter niet immunogeen. Het komt structureel overeen met polysachariden die in weefsels van de mens, met name in de hersenen, voorkomen. Vaccins op basis van andere oppervlakteantigenen dan het kapsel kunnen hier uitkomst bieden. Deze vaccins zouden bescherming kunnen bieden tegen meningokokken, ongeacht de serogroep. Verschillende producenten van vaccins hebben een meningokokkenvaccin op basis van oppervlakteantigenen in ontwikkeling, maar geen ervan is geregistreerd. (3-7)
Streptococcus pneumoniae
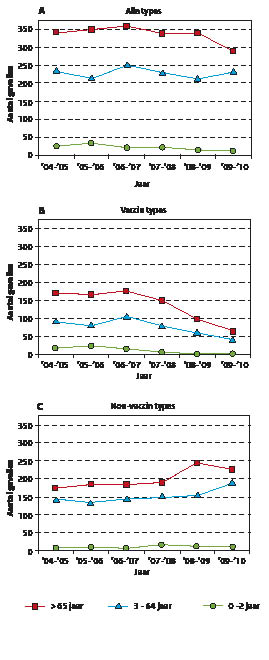
Sinds 1979 verzamelt het NRLBM pneumokokkenisolaten uit liquor of bloed van patiënten met meningitis. De isolaten uit bloed zijn niet altijd aan meningitis gerelateerd en omdat het aantal in de loop der jaren sterk was toegenomen, is besloten vanaf 2003 alleen van 9 peilstations, laboratoria geografisch verdeeld over het land met in totaal een dekking van 25% van de bevolking, nog de bloedisolaten te vragen. S. pneumoniae-stammen kunnen worden onderscheiden op basis van hun kapselpolysacharide dat de productie van serotypespecifieke beschermende antistoffen stimuleert. Er zijn meer dan 90 serotypes van S. pneumoniae bekend. Sinds 1 april 2006 is een geconjugeerd 7-valent vaccin (PCV7 (pneumokokkenconjugaatvaccin 7)) tegen pneumokokken in het RVP (Rijksvaccinatie programma) opgenomen en worden kinderen op de leeftijd van 2, 3, 4 en 11 maanden gevaccineerd. Al in het eerste epidemiologische jaar (juni 2006 tot juni 2007) na introductie van PCV7 was een effect waarneembaar: het aantal gevallen onder kinderen jonger dan 2 jaar van invasieve ziekte veroorzaakt door pneumokokken met een vaccintype nam af en daalde in de daarop volgende jaren verder. (Figuur 5 en 6) Echter, het gunstig vaccineffect werd deels teniet gedaan door een toename van het aantal gevallen door pneumokokken met non-vaccintypes. In de periode juni 2008 tot juni 2009 nam ook het aantal gevallen van meningitis door pneumokokken met vaccintypes af onder niet-gevaccineerden, dat ook weer deels teniet werd gedaan door een toename van het aantal gevallen door non-vaccintypes. Tot nu toe zijn er 4 gevallen van vaccinfalen waargenomen; 2 patiënten (gevaccineerd met 3 respectievelijk 4 doses) met een serotype 6B en 2 patiënten (gevaccineerd met 3 respectievelijk 4 doses) met een serotype 19F S. pneumoniae- infectie. Per 1 mei 2011 wordt het PCV7 in het RVP vervangen door een vaccin met een wat uitgebreidere dekking, het 10-valente vaccin (PCV10 (Synflorix®)). Het NRBLM zal het effect hiervan op de incidentie van invasieve pneumokokkenziekte nauwkeurig gaan volgen.
Figuur 5: Aantal gevallen van pneumokokkenmeningitis naar leeftijd, juni 2001-juni 2010. Data betreft aantal alle isolaten uit liquor uit het gehele land
Figuur 6: Aantal gevallen van invasieve pneumokokkenziekte anders dan meningitits naar leeftijd, juni 2001-juni 2010. Data betreft aantal alle isolaten uit bloed afkomstig van de 9 peilstations met een dekking van 25%.
Conclusies
De incidentie van bacteriële meningitis is het laatste decennium meer dan gehalveerd. Dit wordt voornamelijk verklaard door een sterke afname van de incidentie van meningokokkenziekte. De introductie van het vaccin tegen serogroep C-meningokokken en een natuurlijke daling van de incidentie van ziekte door serogroep B-meningokokken zijn hier debet aan. De introductie van het 7-valente conjugaatvaccin tegen pneumokokken deed de incidentie van invasieve pneumokkenziekte afnemen en niet alleen onder gevaccineerden. De natuurlijke fluctuatie van de incidentie van meningokokkenziekte en de introductie van nieuwe vaccins tegen meningokokken en pneumokokken maken een blijvende surveillance van bacteriële meningitis onontbeerlijk.
Dankbetuiging
Zonder de medewerking van de artsen-microbiologen
van de inzendende laboratoria zou het werk van het NRLBM niet mogelijk zijn. De auteurs danken hen voor hun enthousiaste bijdragen.
Auteurs
A. van der Ende, L. Spanjaard, Nederlands Referentielaboratorium voor Bacteriële Meningitis, Academisch Medisch Centrum Amsterdam
Correspondentie:
A. van der Ende | a.vanderende@amc.uva.nl
Literatuur
- Elias J, Schouls LM, van de Pol I, Keijzers WC, Martin DR, Glennie A, Oster P, Frosch M, Vogel U, van der Ende A. Vaccine preventability of meningococcal clone, Greater Aachen Region, Germany. Emerg Infect Dis. 2010;16:465-72.
- Heckenberg SG, de Gans J, Brouwer MC (medisch centrum), Weisfelt M, Piet JR, Spanjaard L, van der Ende A, van de Beek D. Clinical features, outcome, and meningococcal genotype in 258 adults with meningococcal meningitis: a prospective cohort study. Medicine (Baltimore). 2008;87:185-92.
- Findlow J, Borrow R, Snape MD, Dawson T, Holland A, John TM, Evans A, Telford KL, Ypma E, Toneatto D, Oster P, Miller E, Pollard AJ. Multicenter, open-label, randomized phase II controlled trial of an investigational recombinant Meningococcal serogroup B vaccine with and without outer membrane vesicles, administered in infancy. Clin Infect Dis. 2010;51:1127-37.
- Giuliani MM, Adu-Bobie J, Comanducci M, Aricò B, Savino S, Santini L, Brunelli B, Bambini S, Biolchi A, Capecchi B, Cartocci E, Ciucchi L, Di Marcello F, Ferlicca F, Galli B, Luzzi E, Masignani V, Serruto D, Veggi D, Contorni M, Morandi M, Bartalesi A, Cinotti V, Mannucci D, Titta F, Ovidi E, Welsch JA, Granoff D, Rappuoli R, Pizza M. A universal vaccine for serogroup B meningococcus. Proc Natl Acad Sci U S A. 2006;103:10834-9.
- Jiang HQ, Hoiseth SK, Harris SL, McNeil LK, Zhu D, Tan C, Scott AA, Alexander K, Mason K, Miller L, DaSilva I, Mack M, Zhao XJ, Pride MW, Andrew L, Murphy E, Hagen M, French R, Arora A, Jones TR, Jansen KU, Zlotnick GW, Anderson AS. Broad vaccine coverage predicted for a bivalent recombinant factor H binding protein based vaccine to prevent serogroup B meningococcal disease. Vaccine. 2010;28:6086-93.
- Keiser PB, Biggs-Cicatelli S, Moran EE, Schmiel DH, Pinto VB, Burden RE, Miller LB, Moon JE, Bowden RA, Cummings JF, Zollinger WD. A phase 1 study of a meningococcal native outer membrane vesicle vaccine made from a group B strain with deleted lpxL1 and synX, over-expressed factor H binding protein, two PorAs and stabilized OpcA expression. Vaccine. 2011;29:1413-20.
- Vogel U, Claus H. Vaccine development against Neisseria meningitidis. Microb Biotechnol. 2010;4:20-31.