Respiratoir syncytieel virus (RSV (Respiratoir Syncytieel Virus)) veroorzaakt ernstige luchtweginfecties bij baby’s en ouderen. Er bestaat op dit moment geen effectieve behandeling en preventie is alleen mogelijk bij een zeer kleine populatie van kwetsbare kinderen. In dit artikel worden aan de hand van de pathofysiologie nieuwe ontwikkelingen op het gebied van therapie en preventie besproken.
content
Auteur: L. Bont
Infectieziekten Bulletin: juni 2016, jaargang 27, nummer 6
RSV (Respiratoir Syncytieel Virus) is een belangrijke verwekker van bronchiolitis, maar ook van bronchitis, pneumonie en otitis op de kinderleeftijd. (1) Minder bekend is dat ook ouderen kwetsbaar zijn voor RSV. (2) Het virus kan eenvoudig worden aangetoond in de luchtwegen met een PCR (polymerase chain reaction)-test (polymerase chain reaction). Alle kinderen in Nederland worden voor de leeftijd van 2 jaar geïnfecteerd met RSV, hiervan wordt 1%, ofwel 2000 kinderen, in het eerste levensjaar opgenomen in het ziekenhuis als gevolg van RSV-infectie. Meestal hebben zij bronchiolitis, hierbij worden zuigelingen neusverkouden, waarna zij last krijgen van voedingsproblemen, hoesten en een piepend verlengde uitademing. Tien procent van hen wordt opgenomen op een intensivecareafdeling in verband met falen van de ademhaling. Kinderen met een verhoogd risico op een ernstig beloop van RSV-infectie zijn kinderen die te vroeg geboren zijn, een congenitale hartafwijking hebben of geboren zijn met het syndroom van Down. In Nederland is overlijden door RSV-infectie uitzonderlijk, maar wereldwijd sterven 253.000 kinderen jaarlijks aan RSV-luchtweginfecties, vooral in gebieden waar geen intensivecareafdelingen beschikbaar zijn. (3) De helft van de kinderen met RSV-bronchiolitis ontwikkelt terugkerende episodes van piepende ademhalingsklachten. Een deel van deze kinderen wordt op de schoolleeftijd gediagnosticeerd met astma met verminderde longfunctie. (4)
Pathofysiologie
De pathogenese van RSV is nog altijd onduidelijk. Vrijwel alle kinderen worden geïnfecteerd met RSV in de eerste 2 levensjaren, maar de meeste ontwikkelen niet meer dan een neusverkoudheid. Leeftijd is een factor die in belangrijke mate ziekte-ernst bepaalt. De meeste kinderen die worden opgenomen wegens RSV-bronchiolitis zijn niet ouder dan 3-4 maanden oud. Een verminderde longfunctie bij de geboorte wordt vaker gezien bij kinderen die worden opgenomen wegens RSV-bronchiolitis. Tweelingstudies suggereren dat ongeveer 20% van het risico op RSV-bronchiolitis genetisch is bepaald. (5) Variatie in genen van het aangeboren afweersysteem draagt bij aan het risico op RSV-bronchiolitis.
De afweerreactie en virale replicatie in de mucosa van de luchtwegen spelen beide een belangrijke rol in de pathogenese van RSV-bronchiolitis. De vraag is nu welke schade het virus direct toebrengt aan de luchtwegen. Het eerlijke antwoord is dat we hierover weinig weten, omdat we niet bij het longweefsel kunnen komen. Er zijn aanwijzingen dat RSV een agressief virus is dat directe schade toebrengt. (6) In vitro infectie van epitheel leidt snel tot sterfte van epitheelcellen. Er is ook indirect bewijs dat RSV zelf beschadigend is. Er is een relatie tussen de ernst van de ziekte en virale replicatie, suggererend dat het cytopathologisch effect van RSV de ziekte-ernst bepaalt.
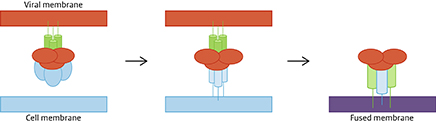
Figuur 1. De prefusie variant van het fusie-eiwit is de achilleshiel van RSV. (Bron: McLellan, Structure of RSV fusion glycoprotein trimer bound to a prefusion-specific neutralizing antibody, Science 2013)
Aan de andere kant zijn er óók aanwijzingen dat RSV zelf niet zoveel schade toebrengt. Er worden vaak zeer hoge virale concentraties gevonden bij kinderen met uitsluitend klachten van neusverkoudheid. Bij patiënten met RSV-bronchiolitis zijn 80 tot 90% van alle cellen in de spoeling neutrofiele granulocyten zijn, terwijl bij gezonde mensen geen neutrofielen in de luchtwegen worden aangetroffen. (7) Uit recent onderzoek blijkt dat neutrofielen naast een antibacteriële functie ook een antivirale functie hebben. Neutrofielen kunnen virus opnemen en doden en ze kunnen antivirale eiwitten maken. Verder kunnen ze zogenoemde neutrophil extracellular traps (NETs) maken, dit zijn letterlijk netten van DNA (deoxyribonucleic acid) die niet alleen bacteriën, maar ook de veel kleinere virussen kunnen vangen. Kortom, de afweer door neutrofiele granulocoten is nodig voor een effectieve virale klaring, maar veroorzaakt ook altijd weefselschade.
Therapie en Preventie
Er bestaat geen specifieke therapie tegen RSV-infectie. Ribavirine heeft goede in vitro antivirale eigenschappen, maar is klinisch niet effectief. Een aantal fusieremmers en een nucleoside analoog zijn ontwikkeld voor de behandeling van RSV-infecties. (4) Ze zijn effectief in diermodellen. In 2 recente publicaties in New England Journal of Medicine. (8,9) bleken sommige ook effectief bij de behandeling van experimentele RSV-infectie van gezonde volwassen. Resultaten van fase-2-trials worden in 2016 en 2017 verwacht. Een belangrijk vraag die voorligt, is of RSV-infectie tijdig kan worden gediagnosticeerd om antivirale therapie voldoende vroeg in het beloop van de ziekte toe te kunnen dienen. Voor influenza is bekend dat therapie alleen effectief is indien toegediend binnen 48 uur na het optreden van de eerste symptomen.
Preventie van ernstige RSV-infectie is op dit moment alleen mogelijk bij kinderen die een hoog risico lopen op een ernstig beloop van RSV-infectie (hoogrisicokinderen). En dan alleen door maandelijkse intramusculaire toediening van monoklonale antistoffen tegen het RSV F-glycoproteine (palivizumab). Voor de meeste hoogrisicokinderen wordt deze vorm van passieve immunisatie echter niet toegepast vanwege de hoge kosten van deze monoklonale antistoffen.
Hoe zijn de vooruitzichten op een RSV-vaccin? In 2 recente Science publicaties wordt het F-eiwit als de ‘achillespees’ van RSV getoond. (10,11) Het F-eiwit zit aan de buitenkant van het virus, dus daar waar het virus het meest kwetsbaar is. De functionele prefusievariantvan het F-eiwit strekt zich uit naar de luchtwegpitheelcel en zorgt voor versmelting van het virus met de epitheelcel. De versmelting vindt plaats in een split second. Na fusie met de cel zakt het F-eiwit in elkaar waarbij de post-fusievariant van het F-eiwit zonder functie achterblijft. Immuniteit tegen het prefusievariant van het RSV-F-eiwit blijkt zeer goed te beschermen.
Op dit moment zijn er 10 vaccins die in een zodanig stadium van ontwikkeling zijn dat ze bij mensen worden getest. Nanoparticlevaccins, subunitvaccins, levend-verzwakte vaccins en vectorvaccins worden ontwikkeld. (4) Er zijn 3 strategieën die allemaal een goede succeskans hebben: vaccins voor toediening aan baby’s of andere kwetsbare populaties, toediening bij de geboorte van RSV-antistoffen met zeer lange halfwaardetijd en vaccins voor toediening aan zwangere vrouwen.
In 2015 werden 2 fase III trials gestart met een nanoparticlevaccin, één bij ouderen en één bij zwangere vrouwen. We zullen zorgvuldig moeten omgaan met gebruik van maternale vaccinatie, vaccinatie tijdens het tweede of derde trimester van de zwangerschap. (12) Vaccinatie van zwangere vrouwen tegen kinkhoest gebeurt al routinematig in België, Engeland, de Verenigde Staten en zelfs in Zuid-Afrika. Naar verwachting zal ook in Nederland maternale kinkhoestvaccinatie worden geïntroduceerd voor alle zwangere vrouwen. Tot op heden is er gelukkig geen schadelijke bijwerking van enig maternaal vaccin voor het ongeboren kind gevonden. Toch moeten we alert blijven of maternale vaccins inderdaad zo veilig zijn als we nu denken.
Tenslotte wordt er succesvol gewerkt aan de introductie van een antistof met een verlengde halfwaardetijd gericht op de prefusievariant van het RSV F-eiwit. (13) Door een aminozuursubstitutie M252Y/S254T/T256E [YTE] van het Fc-deel wordt beoogd RSV-infectie in de eerste maanden na de geboorte te voorkomen door een enkele injectie van deze antistof direct na de geboorte van alle pasgeborenen. Er wordt hierdoor ook wel gesproken van passieve vaccinatie, hoewel deze term uiteraard onjuist is, omdat er geen immuunrespons wordt opgewekt.
Conclusie
RSV veroorzaakt ernstige luchtweginfecties bij baby’s en ouderen. Er bestaat geen effectieve therapie en preventie is alleen mogelijk bij een zeer kleine populatie van kwetsbare kinderen. Ziekte-ernst wordt bepaald door schade aan het luchtwegepitheel door het virus zelf in combinatie met immuunschade, vooral veroorzaakt door de massale influx van neutrofiele granulocyten naar de luchtwegen. Meerdere antivirale middelen, vergelijkbaar met oseltamivir voor influenza, worden ontwikkeld. Of deze op zichzelf effectief zijn of alleen in combinatie met immuunmodulerende farmaca moet nog blijken. Ook preventieve interventies worden op dit moment succesvol ontwikkeld. Vaccins voor ouderen, zwangere vrouwen en kinderen worden in fase III trials getest of naderen dit moment. (4) Parallel hieraan wordt gewerkt aan passieve vaccinatie tegen RSV-infecties door middel van het eenmalig toedienen van RSV-antistoffen met verlengde halfwaardetijd aan alle pasgeboren kinderen. Zonder twijfel zullen we binnen 10 jaar in staat zijn het virus te beteugelen dat op dit moment nog zoveel morbiditeit en sterfte wereldwijd veroorzaakt.
Prof. Dr. Louis Bont is sinds 2015 hoogleraar Luchtweginfecties op de Kinderleeftijd aan de Universiteit Utrecht. Zijn specifieke interesse gaat uit naar het respiratoir syncytieel virus (RSV) in relatie met astma-ontwikkeling. Louis Bont leidt een onderzoeksgroep die zich bezighoudt met het bestuderen en bestrijden van de gevolgen van RSV-bronchiolitis. Daarnaast zit hij in een onderzoeksteam dat de rol bestudeert van afweercellen tijdens RSV-infecties met als doel om via remmende receptoren het afweersysteem te dempen. Louis Bont is medeoprichter van het programma Training of Upcoming Leaders In Pediatric Sciences (TULIPS), een carrièretrainingsprogramma voor clinici-onderzoekers in Child Health.
Auteur
L. Bont, Universiteit Utrecht
Correspondentie
- Meissner HC. Viral Bronchiolitis in Children. N Engl J Med. 2016;374(1):62-72.
- Falsey AR, Hennessey PA, Formica MA, Cox C, Walsh EE. Respiratory syncytial virus infection in elderly and high-risk adults. N Engl J Med. 2005;352(17):1749-59.
- Nair H, Nokes DJ, Gessner BD, Dherani M, Madhi SA, Singleton RJ, et al. Global burden of acute lower respiratory infections due to respiratory syncytial virus in young children: a systematic review and meta-analysis. Lancet. 2010;375(9725):1545-55.
- Mazur NI, Martinon-Torres F, Baraldi E, Fauroux B, Greenough A, Heikkinen T, et al. Lower respiratory tract infection caused by respiratory syncytial virus: current management and new therapeutics. Lancet Respir Med. 2015;3(11):888-900.
- Thomsen SF, van der Sluis S, Stensballe LG, Posthuma D, Skytthe A, Kyvik KO, et al. Exploring the association between severe respiratory syncytial virus infection and asthma: a registry-based twin study. Am J Respir Crit Care Med. 2009;179(12):1091-7.
- Miyairi I, DeVincenzo JP. Human genetic factors and respiratory syncytial virus disease severity. Clin Microbiol Rev. 2008;21(4):686-703.
- Geerdink RJ, Pillay J, Meyaard L, Bont L. Neutrophils in respiratory syncytial virus infection: A target for asthma prevention. J Allergy Clin Immunol. 2015;136(4):838-47.
- DeVincenzo JP, McClure MW, Symons JA, Fathi H, Westland C, Chanda S, et al. Activity of Oral ALS (Amyotrofische Laterale Sclerose)-008176 in a Respiratory Syncytial Virus Challenge Study. N Engl J Med. 2015;373(21):2048-58.
- DeVincenzo JP, Whitley RJ, Mackman RL (richtlijn), Scaglioni-Weinlich C, Harrison L, Farrell E, et al. Oral GS-5806 activity in a respiratory syncytial virus challenge study. N Engl J Med. 2014;371(8):711-22.
- McLellan JS (Joint Strike Fighter), Chen M, Joyce MG, Sastry M, Stewart-Jones GB, Yang Y, et al. Structure-based design of a fusion glycoprotein vaccine for respiratory syncytial virus. Science. 2013;342(6158):592-8.
- McLellan JS, Chen M, Leung S, Graepel KW, Du X, Yang Y, et al. Structure of RSV (Respiratoir Syncytieel Virus) fusion glycoprotein trimer bound to a prefusion-specific neutralizing antibody. Science. 2013;340(6136):1113-7.
- Chu HY, Englund JA. Maternal immunization. Clin Infect Dis. 2014;59(4):560-8.
- Robbie GJ, Criste R, Dall'acqua WF, Jensen K, Patel NK, Losonsky GA, et al. A novel investigational Fc-modified humanized monoclonal antibody, motavizumab-YTE, has an extended half-life in healthy adults. Antimicrob Agents Chemother. 2013;57(12):6147-53.