Kinkhoest kan een zeer gevaarlijke infectie zijn voor zuigelingen jonger dan 6 maanden. De discussie over effectieve maatregelen om de zuigelingen te beschermen draait vooral om vaccinatie van net geboren baby’s (neonatale vaccinatie), vaccinatie van zwangere vrouwen (maternale vaccinatie) en vaccinatie van vrouwen die net zijn bevallen (cocooning). Naar aanleiding van deze discussies is de vraag ontstaan of deze maatregelen om besmetting van ongevaccineerde zuigelingen te voorkomen kosteneffectief zijn. Hier laten we de resultaten zien van het onderzoek naar de kosteneffectiviteit van 2 vaccinatiestrategieën: vaccinatie van zwangere vrouwen (maternale vaccinatie) en vaccinatie van vrouwen die net zijn bevallen (cocooning). (1) Het blijkt dat naast de ernst van de ziekte, de kosteneffectiviteit afhankelijk is van de incidentie, gebaseerd op de meldingen van ziekte en sterfte.
ib oktober 2014
Auteurs: A.K. Lugnér, N. van der Maas, M. van Boven, F.R. Mooi, H.E. de Melker
Infectieziekten Bulletin, jaargang 25, nummer 8, oktober 2014
Als een kind 2 maanden oud is krijgt het de eerste van een serie prikken tegen kinkhoest uit het Rijksvaccinatieprogramma (RVP (Rijksvaccinatie programma)). De volgende vaccinaties worden gegeven op 3, 4 en 11 maanden, en een booster vaccinatie op 4 jarige leeftijd. De vaccinatiegraad voor DKTP (difterie kinkhoest tetanus polio) (difterie, kinkhoest, tetanus,polio) in Nederland is relatief constant over de tijd, en ligt voor zuigelingen al jaren rond de 95%. (2) Ondanks de hoge vaccinatiegraad komt er om de 4-5 jaar een kinkhoestepidemie voor, waardoor in 2012 de incidentie van kinkhoest uitzonderlijk hoog was. Tijdens een epidemie zien we voornamelijk een toename van kinkhoest onder jonge, nog niet (volledig) gevaccineerde baby’s, onder kinderen vanaf 9 jaar en onder jongvolwassenen.
Een van de vragen die beantwoord moet worden voordat een nationaal vaccinatieprogramma ingevoerd kan worden, is of het geld dat er aan besteed wordt ook voldoende gezondheidswinst oplevert tegenover de kosten van het programma. (3) Een middel om dat te bepalen is de kosteneffectiviteitsanalyse.
Methode
De kosteneffectiviteit wordt uitgedrukt als kosten voor het vaccineren per gewonnen QALY (quality-adjusted life years) (quality-adjusted life year). De QALY weegt zowel de levensverwachting als de kwaliteit van leven, en bepaalt de zogenaamde verdisconteerde levensverwachting. Zo levert bijvoorbeeld het voorkómen van 1 sterftegeval van een zuigeling 46 gewonnen QALY op. De kosteneffectiviteit is een berekening van de vaccinatiekosten minus de bespaarde kosten (doordat er minder behandelingskosten zijn). Dat bedrag wordt gedeeld door de gezondheidswinst (doordat er minder infecties zijn). Hoewel er in Nederland geen officieel afkappunt wordt aan gehouden, wordt een grens van €20.000 per QALY vaak gezien als drempelwaarde voor een kosteneffectieve interventie. Zijn de kosten voor een preventieve maatregel hoger dan €50.000 per QALY, dan wordt deze als niet kosteneffectief beschouwd. (3)
We hebben de 2 scenario’s onderzocht voor een 10 jaar durend programma. In de berekeningen is er rekening mee gehouden dat de bescherming tegen een kinkhoestinfectie wegebt na 5 jaar. Dat houdt in, dat bij cocooning de moeder een pasgeborene, of overige gezinsleden, de eerste 5 jaar na vaccinatie niet zal besmetten. Wil maternale vaccinatie effectief zijn, moeten de antilichaamconcentraties die tijdens de zwangerschap overgedragen worden op het ongeboren kind, hoog genoeg zijn. Deze dalen echter in de moeder binnen 1 jaar tot een niveau dat als onvoldoende wordt beschouwd voor bescherming.(4) Bij maternale vaccinatie moet een vrouw dus bij elke zwangerschap opnieuw worden gevaccineerd om haar ongeboren kind voldoende antistoffen mee te kunnen geven.
Het aantal infecties voor en na vaccinatie is gebaseerd op de wettelijke meldingen uit 2002-2011. Echter, niet alle infecties worden geregistreerd. Er zijn schattingen dat er een 100-voudige onderrapportage is, met name voor infecties onder volwassenen. (5,6) Doordat kinkhoest in baby’s vaak ernstig verloopt, nemen we aan dat het aantal kinkhoestmeldingen bij 0-6 maanden oude kinderen wel representatief is.
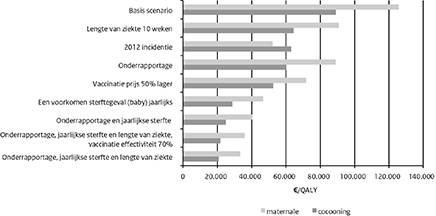
Figuur 1 Gevoeligheidsanalyse van aanames gemaakt in de analyses
Om de gezondheidswinst voor de baby’s te schatten bij maternale vaccinatie moet men weten hoe vaak een baby door de moeder besmet wordt. Wij baseren ons op een Nederlands onderzoek in gezinnen met een geïnfecteerde baby. (7) Het percentage besmettingen dat voorkomen zou kunnen worden door vaccinatie van moeders, is hierbij geschat op 58%, uitgaande van een vaccineffectiviteit van 89%. Daarnaast veronderstellen we dat 75% van de moeders en/of zwangere vrouwen zich laat vaccineren (overeenkomstig de vaccinatiegraad van de jaarlijkse seizoensgriepvaccinatie).
De ziektelast is een samenstelling van de verminderde kwaliteit van leven (KvL) tijdens de ziekte en de tijd dat de ziekte duurt. Om het verlies van KvL in baby’s en volwassene te berekenen, hebben we gebruik gemaakt van eerdere studies die de KvL hebben geschat. (8) We hebben aangenomen dat de duur van de ziekte 6 weken is in zowel de moeder als het kind.
De kosten voor vaccineren (vaccin- en administratiekosten: € 27) en kosten voor behandeling van een infectie (voor een baby €5400 en voor een volwassene €20-140) zijn in een eerdere studie berekend. (9)
Samenvattend zijn de belangrijkste aannames: de onderrapportage (100 keer hoger dan aangiftes voor volwassene), de ziektelast (verlies in kwaliteit van leven per ziektegeval: zuigeling 0,0323, volwassene 0,005), 2 sterfgevallen in 10 jaar onder zuigelingen, vaccineffectiviteit 89%.
Resultaten
Met de cocooning en maternale vaccinatieprogramma’s zouden jaarlijks respectievelijk 17 en 20 QALY gewonnen kunnen worden. De kosten voor vaccineren zouden respectievelijk 1,5 en 2,5 miljoen euro bedragen, inclusief besparingen door een lagere aanspraak op de gezondheidszorg. Dit betekent dat de kosten voor cocooning en maternale vaccinatie €89.000/QALY en €126.000/QALY bedragen. Geen van beide onderzochte vaccinatieopties blijkt dus kosteneffectief volgens de gebruikelijke drempelwaarden.
Wij hebben naast bovenstaand basisscenario ook een aantal gevoeligheidsanalyses uitgevoerd om te bestuderen hoe de kosteneffectiviteit afhangt van de aannames, die we gedaan hebben in het basisscenario. In het bijzonder hebben we ons gericht op de onderrapportage (200 in plaats van 100 keer hoger dan aangiftes), de ziektelast (ziekteduur 10 weken in plaats van 6), de sterfte in zuigelingen (1 per jaar in plaats van 2 in 10 jaren), de vaccineffectiviteit (70% in plaats van 89%) en een halvering van de vaccinprijs. In 1 scenario hebben we ook verondersteld dat de hoge incidentie van 2012 gedurende 10 jaar constant blijft. De resultaten hiervan zijn gepresenteerd in de figuur. Die laat zien dat als er jaarlijks 1 sterftegeval onder zuigelingen voorkomen kan worden, of een combinatie van de factoren waarvoor we aannames hebben gemaakt tegelijk voorkomen, de kosteneffectiviteit onder €50.000 per QALY zal vallen.
Beschouwing
Wij concluderen dat vaccinatie van moeders tijdens of net na de zwangerschap om besmetting van hun baby’s te voorkomen, niet kosteneffectief is. Ook als we de aannames van de onderliggende analyses variëren lijkt het onwaarschijnlijk dat vaccinatie kosteneffectief is.
Onze resultaten komen in eerste instantie niet overeen met een eerdere studie die dezelfde vaccinatie- strategieën heeft geëvalueerd. (10) Het verschil komt vooral door de aannames over de onderrapportage en de ziektelast.
Een aantal factoren is niet verwerkt in de analyses, zoals de uitvoerbaarheid en de acceptatie van beide vaccinatie programma’s, en de eventuele effecten van maternale vaccinatie op de immuunrespons tegen kinkhoestvaccinatie in zuigelingen. Daarnaast spelen behalve kosteneffectiviteit ook ethische factoren een rol. Immers, beide vaccinatiestrategieën kunnen de ziektelast verlagen, en het niet aanbieden van een effectieve maatregel zou als onethisch kunnen worden beschouwd. Kinkhoest verloopt het meest ernstig bij zuigelingen en met de huidige vaccinatiestrategie blijft dit gezondheidsprobleem bestaan. Aan de andere kant kan het ook onethisch zijn om mensen die zelf een klein risico op ernstige ziekte lopen, te vaccineren (met het risico op bijwerkingen) om hiermee anderen te beschermen. Zulke afwegingen zijn in ieder vaccinatieprogramma van belang, en laten zich niet gemakkelijk vangen in een economische analyse naar de kosteneffectiviteit. Uit de gevoeligheidsanalyses blijkt dat de incidentie 1 van de belangrijke aspecten is voor de uitkomst van de analyse. Dat geeft aan dat als kinkhoest zou voorkomen met een stabiele incidentie op het niveau van de incidentie in 2012, de kosteneffectiviteit van vaccinatie van zwangere vrouwen opnieuw geëvalueerd zou moeten worden.
Tot slot moet opgemerkt worden dat maternale vaccinatie al wordt toegepast in veel landen om ons heen zoals de Verenigde Staten, Engeland, België en Oostenrijk. Uit Engelse onderzoeken blijkt dat maternale vaccinatie zeer effectief is, met een effectiviteit van ongeveer 90%. (11)
Auteurs
A.K. Lugnér, N. van der Maas, M. van Boven, F.R. Mooi, H.E. de Melker, Centrum Infectieziektebestrijding, RIVM
Correspondentie
- Lugnér AK, van der Maas N, van Boven M, Mooi FR, de Melker HE. Cost-effectiveness of targeted vaccination to protect newborns against pertussis: comparing neonatal, maternal, and cocooning vaccination strategies. Vaccine 2013; 31:5392-7.
- T.M. Schurink-van ’t Klooster, H.E. de Melker (eds). The National Immunisation Programme in the Netherlands Developments in 2013. RIVM Report 150202002/2013. Bilthoven: Rijksinstituut voor Volksgezondheid en Milieu, 2013 (p. 27).
- Kimman TG, Boot HJ, Berbers GAM, Vermeer-de Bondt PE, de Wit GA, de Melker HE. Developing a vaccination evaluation model to support evidence-based decision making on national immunization programs. Vaccine 2006; 24:4769–78.
- Edwards, K.M., B.D. Meade, M.D. Decker, G.F. Reed, M.B. Rennels, M.C. Steinhoff, et al., Comparison of 13 acellular pertussis vaccines: overview and serologic response. Pediatrics, 1995. 96:548-57.
- de Greeff, S.C., H.E. de Melker, P.G. van Gageldonk, J.F. Schellekens, F.R. van der Klis, L. Mollema, et al., Seroprevalence of pertussis in The Netherlands: evidence for increased circulation of Bordetella pertussis. PLoS (Plos One) One, 2010. 5:e14183.,
- de Melker, H.E., F.G. Versteegh, J.F. Schellekens, P.F. Teunis, and M. Kretzschmar, The incidence of Bordetella pertussis infections estimated in the population from a combination of serological surveys. J Infect, 2006. 53:106-13.
- de Greeff, S.C., H.E. de Melker, A. Westerhof, J.F. Schellekens, F.R. Mooi, and M. van Boven, Estimation of household transmission rates of pertussis and the effect of cocooning vaccination strategies on infant pertussis. Epidemiology, 2012; 23:852-60.
- Lee, G.M., J.A. Salomon, C.W. LeBaron, and T.A. Lieu, Health-state valuations for pertussis: methods for valuing short-term health states. Health Qual Life Outcomes, 2005; 3:17.
- de Greeff, S.C., A.K. Lugnér, D.M. van den Heuvel, F.R. Mooi, and H.E. de Melker, Economic analysis of pertussis illness in the Dutch population: implications for current and future vaccination strategies. Vaccine 2009; 27:1932-7.
- Westra, T.A., R. de Vries, J.J. Tamminga, C.J. Sauboin, and M.J. Postma, Cost-effectiveness analysis of various pertussis vaccination strategies primarily aimed at protecting infants in the Netherlands. Clin Ther, 2010. 32:1479-95)
- ACIP (Advisory Committee on Immunization Practices). Summary Report June 19-20; 2013 (pp 46-73).