Het percentage Nederlanders dat geïnfecteerd is met humaan papillomavirus ( HPV (humaan papillomavirus)), veroorzaker van onder andere baarmoederhalskanker, is met 3 procent toegenomen in de periode tussen 1996 (20.0%) en 2007 (23.1%). Opvallend daarbij is de toename van HPV-infecties onder meisjes en vrouwen in de leeftijdsgroep tussen 15 en 24 jaar. Antilichamen die het lichaam zelf aanmaakt tegen een HPV-infectie beschermen niet volledig, dit betekent dat iemand opnieuw kan worden geïnfecteerd. Het HPV-vaccin biedt wel goede bescherming en HPV-antilichamen zijn detecteerbaar in de omgeving van de baarmoederhals bij gevaccineerde meisjes.
ib maart 2014
Auteur: M. Scherpenisse
Infectieziekten Bulletin, jaargang 25, nummer 3, maart 2014
Baarmoederhalskanker is een van de meest voorkomende kankers wereldwijd. Bij 99,7% van de patiënten met baarmoederhalskanker is een persistente infectie met het HPV (humaan papillomavirus) de oorzaak. HPV veroorzaakt niet alleen baarmoederhalskanker, maar kan ook bijdragen aan de ontwikkeling van kanker aan de anus, vulva, vagina, penis, mond en keel. HPV16 en HPV18 zijn de meest voorkomende hoogrisico HPV-typen en samen verantwoordelijk voor 70% van alle gevallen van baarmoederhalskanker. HPV infecteert voornamelijk de genitale regio. Daarom is het slijmvlies van de genitale regio de eerste verdedigingszone tegen HPV-infecties.
Er zijn 2 vaccins ontwikkeld tegen de meest voorkomende hoogrisico HPV-types, HPV16 en 18. Het quadrivalente HPV-vaccin (Gardasil) beschermt tegen infecties met HPV6, 11, 16 en 18 en het bivalente HPV-vaccin (Cervarix) beschermt tegen infecties met HPV16 en 18. Beide vaccins hebben een profylactische werking. Het bivalente HPV-vaccin is opgenomen in het Rijksvaccinatieprogramma (
RVP
(Rijksvaccinatie programma))voor 12-jarige meisjes. Daarnaast is er een eenmalige inhaalcampagne georganiseerd waarbij meisjes van
13 tot 16 jaar zich konden laten vaccineren. In Nederland was de vaccinatiegraad in eerste instantie rond 50%, mede door de negatieve media-aandacht, maar deze nam toe tot 56% in 2012. Met de introductie van de HPV-vaccins werd het ook belangrijk om de impact van de HPV-vaccinatie te monitoren in de Nederlandse bevolking. Om bescherming te kunnen bieden, moeten de HPV-vaccins voldoende antilichamen produceren op plekken waar HPV-infecties voorkomen, zoals in de genitale regio.
De biologische relevantie van natuurlijk geïnduceerde HPV-antilichamen, HPV-antilichamen die zijn ontstaan na een infectie, is nog steeds niet duidelijk. Het is bekend dat er een sterk verband is tussen persistente HPV-infecties en de aanwezigheid van HPV-specifieke antilichamen. Kunnen deze natuurlijk verkregen HPV-antilichamen wel bescherming bieden tegen nieuwe HPV-infecties? Wat is het verschil tussen de immuunresponsen welke ontwikkelen na een HPV-infectie en na HPV-vaccinatie? In dit proefschrift zijn de kwaliteit, kwantiteit en karakteristieken van de HPV-antilichaam immuunrespons na HPV-infectie en HPV-vaccinatie onderzocht. HPV-immuunresponsen werden onderzocht in populatie studies, in groepen die in aanmerking kwamen voor HPV-vaccinatie en in immuungecompromitteerde meisjes.
HPV-antilichaamresponsen na een HPV-infectie
Een detecteerbare antilichaamrespons tegen het L1 capside-eiwit van HPV (de eiwitmantel van het virus) wordt ontwikkeld in 50-70% van de geïnfecteerde mensen. Deze natuurlijk verworven HPV-specifieke antilichamen zijn voor lange tijd op relatief constant niveau aanwezig in het bloed. Daarom is de serologische HPV-respons (de detectie van HPV-antilichamen) een maat voor HPV-infecties die in het verleden hebben plaats gevonden.
We hebben gebruik gemaakt van een grote serosurveillancestudie (dwarsdoorsnede van de Nederlandse bevolking) uitgevoerd in 2006-2007. Aan de deelnemers in de studie werd gevraagd om bloed te doneren en om vragenlijsten in te vullen met vragen over demografische karakteristieken, vaccinatiehistorie en informatie over seksueel gedrag. In deze studie hebben we de leeftijdsspecifieke seroprevalentie van HPV-antilichamen in bloed bepaald van 7 hoogrisico HPV-serotypen (HPV16, 18, 31, 33, 45, 52 en 58) onder de Nederlandse bevolking (0-79 jaar oud) vóór de invoering van de HPV-vaccinatie. Omdat HPV een seksueel overdraagbaar virus is en mensen snel na hun eerste seksuele contact geïnfecteerd raken, wordt de HPV-vaccinatie aangeboden aan jonge meisjes. De resultaten van onze studie bevestigen dat dit een goede leeftijd is aangezien een toename in HPV-seroprevalentie onder zowel vrouwen als mannen werd waargenomen rondom de leeftijd van het eerste seksuele contact (15-19 jaar). Deze toename in seroprevalentie was het duidelijkst voor vrouwen. Redelijk constante HPV-seroprevalenties werden waargenomen rond middelbare leeftijd waarna de seroprevalentie in oudere mensen iets daalde.
Seroprevalentiedata van de 12-16 jarigen van voor de invoering van HPV-vaccinatie kunnen gebruikt worden als basis voor het verder evalueren van de langetermijneffecten van deHPV16/18-vaccinatie op de Nederlandse bevolking. Met behulp van deze seroprevalentiestudies kunnen we het effect van vaccinatie op het aantal infecties en als afgeleide daarvan ook op viruscirculatie in zowel mannen als vrouwen onderzoeken. Daarnaast kunnen ook mogelijke veranderingen in het voorkomen van de verschillende HPV-types gemonitord worden en kunnen we meer inzicht krijgen in groepsimmuniteit na HPV-vaccinatie.
Verschuivingen in HPV-seroprevalentie in Nederland
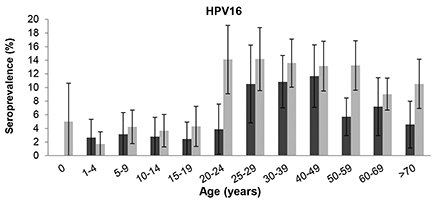
In de loop van de tijd hebben er veranderingen in HPV-seroprevalentie van de 7 hoogrisico HPV-typen onder de Nederlandse bevolking plaatsgevonden. Uit ons onderzoek blijkt dat de HPV-antilichaamseroprevalentie in de Nederlandse bevolking is toegenomen met 3.1% (van 20.0% in 1995-96 naar 23.1% in 2006-07) door een significante stijging in de seroprevalentie voor HPV16, 18, 31 en 45. HPV16 seroprevalentie onder jonge vrouwen is verschoven naar jongere leeftijden (van 20-24 naar 15-19 jaar) (Figuur 1). Waarschijnlijk wordt deze verschuiving in seroprevalentie veroorzaakt door veranderingen in seksueel gedrag in die jaren, in het bijzonder een jongere leeftijd van het eerste seksuele contact Het is interessant dat ook bij personen ouder dan 40 jaar een toename in HPV-seropositiviteit wordt waargenomen in deze periode van 11 jaar. Dit kan verklaard worden door het feit dat nu een hoger percentage ouderen nog steeds seksueel actief is dan voorheen. Dit is misschien het gevolg van de ontwikkelingen op het gebied van therapeutische interventies wat die gebruikt worden wanneer er problemen op seksueel gebied zijn. Ook kunnen seksueel actieve oudere vrouwen kwetsbaarder zijn voor seksueel overdraagbare infecties door de postmenopauzale veranderingen die in hun lichaam optreden. Deze postmenopauzale veranderingen kunnen atrofie of verdunningen in de mucosa veroorzaken waarbij minder cervicale secretie wordt geproduceerd. Dit kan resulteren in kleine wondjes op de cervix. Juist deze kleine wondjes zijn de ingangen waar ziekteverwekkers zoals HPV het lichaam kunnen binnendringen wanneer deze vrouwen seksueel actief zijn.
De op natuurlijke wijze verworven HPV-antilichamen leken niet altijd het virus te kunnen neutraliseren, wat betekent dat na een HPV-infectie mensen opnieuw HPV-infecties kunnen oplopen.
Figuur 1 HPV16-seroprevalentie bij vrouwen in 1995-96 (donkergrijze balken) en 2006-07 (lichtgrijze balken)
HPV-vaccinatie
HPV-prevalentie voor vaccinatie
Tegelijkertijd met het invoeren van de HPV-vaccinatie, werd de HAVANA-studie (HPV Amongst Vaccinated And Non-vaccinated Adolescents) gestart om de eerste effecten van het vaccinatieprogramma te monitoren. In deze studie zijn jonge meisjes (14-16 jaar) geïncludeerd waarvan het normaliter verwacht kan worden dat ze seksueel actief worden in de jaren vlak na vaccinatie. Jaarlijks worden bij deze meisjes cervicale swabs, bloed en cervicale secretiemonsters afgenomen. Deze studie stelt ons in staat om de aanwezigheid van HPV- DNA (deoxyribonucleic acid) in cervicale swabs te monitoren en deze data te koppelen aan de resultaten van HPV-specifieke antilichamen in bloed en in cervicale secretie. Hierdoor is het mogelijk om inzicht te krijgen in de vroege effecten van het HPV-vaccinatieprogramma voor en kort na de introductie van het HPV-vaccin. Zoals verwacht was de HPV-DNA-prevalentie onder jonge meisjes vóór de HPV-vaccinatie laag. In de nabije toekomst zullen de in deze studiepopulatie nieuw verkregen HPV-infecties kunnen worden bestudeerd, in relatie tot de vaccinatiestatus van de meisjes, serostatus en risicofactoren voor HPV-(sero)positiviteit
HPV16/18 -specifieke antilichaamresponsen tot 2 jaar na vaccinatie
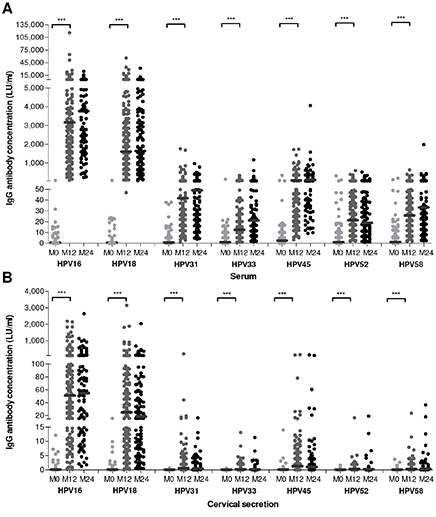
Het bivalente HPV16/18-vaccin induceert hoge antilichaamconcentraties in het bloed. Data over de HPV-antilichaamconcentraties in de cervicale secretie zijn echter beperkt, terwijl juist bij de baarmoeder het HPV-vaccin bescherming moet bieden. IgG (Immunoglobulin G)-antilichamen zijn voornamelijk in het bloed terug te vinden en IgA (Immunoglobuline A)-antilichamen worden voornamelijk geproduceerd bij de mucosa (bijvoorbeeld de genitale regio). Tot in ieder geval 2 jaar na vaccinatie waren HPV16- en 18-specifieke IgG- antilichamen aantoonbaar in het bloed en in de cerviale secretie. IgA-antilichaamconcentraties in bloed en in de cervicale secretie waren veel lager dan de IgG-concentraties.
De correlatie tussen bloed en cervicale secretie van IgG- en IgA-antilichamen was goed, ondanks dat de antilichaamconcentraties in de cervicale secretie veel lager waren dan in het bloed. Ook in de cervicale secretie bleven de antistofconcentraties op een constant niveau tot in ieder geval 2 jaar na vaccinatie. Hieruit kunnen we voorzichtig concluderen dat vaccingeïnduceerde antilichamen vanuit het bloed naar de baarmoeder lekken of dat antilichamen door middel van kleine hoeveelheden bloed, ontstaan bij wondjes, in de cervicale secretie terecht komen. Toch kunnen immunologische mechanismen zoals locale productie van HPV-specifieke antilichamen niet worden uitgesloten.
De hypothese dat HPV-specifieke antilichamen naar de cervicale mucosa lekken wordt ondersteund door de hoge correlaties tussen de IgG-antilichaamconcentraties specifiek voor tetanus toxoid en difterie toxoid in het bloed en in de cervicale secretie. Deze vaccingeïnduceerde antilichamen worden namelijk niet geproduceerd bij de cervix. Op plaatsen waar HPV-infecties voornamelijk plaats vinden dragen transudatie en exudatie van HPV-specifieke antilichamen hoogstwaarschijnlijk bij aan mogelijk voldoende bescherming tegen HPV-infectie en/of herinfecties.
HPV-kruisreagerende antilichaamresponsen na HPV-vaccinatie
IgG-antilichamen geïnduceerd na HPV16/18-vaccinatie kruisreageren ook met HPV-typen 31, 33, 52 en 58, die fylogenetisch gerelateerd zijn aan HPV16 en HPV45 dat gerelateerd is aan HPV18. Het is bekend dat kruisreagerende antilichamen tegen HPV31 en 45 en soms HPV33 ook neutraliserend zijn en eventueel bescherming kunnen bieden tegen HPV31- en HPV45-infecties. Ondanks dat wij ook antilichamen vonden tegen HPV52 en HPV58 na vaccinatie, is er geen biologische relevantie van deze anti-lichaamconcentraties want in vaccinstudies werd geen kruisbescherming gevonden tegen HPV52 en HPV58. In tegenstelling tot kruisreagerende antilichamen ontstaan na een HPV-infectie, kunnen kruisreagerende antilichamen ontstaan na vaccinatie wel gedeeltelijk bescherming bieden tegen nieuwe HPV-infecties. Kruisreagerende antilichamen tegen HPV31 en HPV45 werden ook gedetecteerd in de cervicale secretie tot in ieder geval 2 jaar na vaccinatie.
HPV-vaccinatie bij mensen met een slecht werkend immuunsysteem
Effectief en veilig vaccineren is belangrijk voor mensen die een slecht werkend immuunsysteem hebben wat veroorzaakt kan worden door chronische aandoeningen zoals juveniele idiopathische artritis (JIA, ook wel bekend als jeugdreuma) en systemische lupus erythematosus ( SLE (systemische lupus erythematodes), auto-immuunziekte met symptomen in voornamelijk de organen). Patiënten met JIA of SLE lopen een verhoogd risico op infecties veroorzaakt door de immuunonderdrukkende effecten van hun ziekte of door de medicatie die ze moeten gebruiken. Patiënten met SLE hebben in vergelijking met gezonde mensen, een verhoogd risico op multiple en persistente HPV-infecties die kunnen leiden tot de voorstadia van baarmoederhalskanker.
De immunogeniciteit en de veiligheid van het bivalente HPV-vaccin bij meisjes met JIA, SLE en juveniele dermatomyositis (JDM, auto-immuunziekte die ontstekingen aan huid en aderen veroorzaakt), of overlappende syndromen is onderzocht en is vergeleken met gezonde meisjes tussen de 12-18 jaar. Het HPV-vaccin is veilig en immunogeen in de eerste 12 maanden na de eerste HPV-vaccinatie, maar de JIA-patiënten ontwikkelen wel lagere HPV-specifieke antilichaamconcentraties en minder HPV-specifieke memory B-lymphocyten. Door deze verminderde immuunresponsen in de patiënten met JIA is bescherming tegen HPV-infecties door het HPV-vaccin op lange termijn niet verzekerd. Daarom raden we aan om de HPV-specifieke antilichaamconcentraties in de loop van de tijd te monitoren en daarnaast preventieve maatregelen te nemen door frequent cervicale uitstrijkjes te laten maken bij deze patiënten. Ook in patiënten met SLE, JDM en overlappende syndromen lijkt het HPV-vaccin minder immunogeen te zijn dan bij gezonde meisjes. Een grotere studie is nodig om het mechanisme achter deze verminderde humorale immuunresponsen te achterhalen.
Figuur 2AB IgG-antilichaamconcentratie na HPV-vaccinatie voor HPV16/18 en kruisreagerende HPV-typen (HPV31, 33, 45, 52 en 58) in serum (A) en in cervicale secretie (B) vóór vaccinatie (M0), 1 jaar na de eerste vaccinatie (M12) en 2 jaar na de eerste vaccinatie (M24)
Het belang van HPV-serologie
HPV-specifieke seroprevalentiestudies zijn nodig voor het monitoren van de door vaccinatie verworven bescherming tegen HPV en om informatie te verkrijgen over groepen die (extra) risico lopen op HPV-infecties, groepsimmuniteit na HPV-vaccinatie en veranderingen in het voorkomen van verschillende HPV-types in gevaccineerde mensen. Het is interessant om een volgende serosurveillancestudie uit te voeren waarin de effecten van de HPV-vaccinatie kunnen worden bestudeerd, bijvoorbeeld 10 jaar na de laatste serosurveillancestudie die werd uitgevoerd in 2006-2007. Naast het verzamelen van bloedmonsters in serosurveillancestudies is het interessant om de impact van het HPV-vaccin op het HPV-repertoire, de mogelijke veranderingen hierin en de vaccineffectiviteit te onderzoeken door genitaal DNA onder HPV-gevaccineerde en niet gevaccineerde jong volwassenen te verzamelen. Momenteel is de HPV-vaccinatie alleen routinematig beschikbaar voor jonge meisjes. Toch kunnen jongens ook baat hebben bij HPV-vaccinatie. HPV kan namelijk bij mannnen kanker aan de anus, penis, mond en keel veroorzaken. Bescherming van de meisjes door vaccinatie kan voor de jongens het risico om HPV op te lopen verkleinen. Het effect van groepsimmuniteit neemt toe bij een hogere vaccinatiegraad. In Nederland is de HPV-vaccinatiegraad onder meisjes iets hoger dan 50% en in het geval dat de vaccinatiegraad niet verder zal toenemen, hebben de jongens geen profijt van groepsimmuniteit en kunnen ze beter ook gevaccineerd worden. Ook zou het vaccineren van jongens een stimulerend effect kunnen hebben op de deelname van meisjes aan het HPV-vaccinatieprogramma omdat vaccineren van alleen meisjes bij tegenstanders als discriminatie wordt gezien.
In dit proefschrift hebben we laten zien dat HPV-serologie van groot belang is voor onderzoek naar de immuunrespons na een HPV-infectie en inzicht kan geven in de vaccin geïnduceerde immuunrespons. Het analyseren van HPV-specifieke antilichamen is een belangrijke immunologische tool voor het bestuderen van de kwaliteit, kwantiteit en karakteristieken van een HPV-immuunrespons na zowel een HPV-infectie als na HPV-vaccinatie. Daarnaast is de humorale immuunrespons een belangrijke parameter om de immunologische effecten van vaccinatie op individueel en populatie niveau (bijvoorbeeld groepsimmuniteit) te monitoren.
- Titel: The humoral immune response after HPV infection and prophylactic vaccination: importance of serology
- Auteur: Mirte Scherpenisse
- Promotor: Prof.dr. Chris J.L.M. Meijer
- Co-promotors: dr. Fiona R.M. van der Klis en dr. Guy A.M. Berbers
- Vrije Universiteit, Amsterdam
- ISBN: 978-90-8891664-9
- http://hdl.handle.net/1871/48106
Auteur
M. Scherpenisse, Academisch Medisch Centrum, Amsterdam