Sinds januari 1999 bestaat er een surveillance van Shigatoxineproducerende Escherichia coli (STEC (Shigatoxineproducerende E. coli-stammen)) O157-infecties in Nederland. In 2007 is STEC non-O157 hieraan toegevoegd, hoewel de diagnostiek daarvoor nog niet landelijk dekkend is. In 2012 zijn er 85 patiënten met een STEC O157-infectie, 198 patiënten met een STEC non-O157-infectie en 760 patiënten met STEC zonder verdere bevestiging gemeld. Binnen de STEC non-O157-groep werden O91 (n=30) en O26 (n=29) het meest gevonden. Van de STEC O157-patiënten werd 40% opgenomen in een ziekenhuis (31-54% in eerdere jaren) ten opzichte van 17% van de STEC non-O157-patiënten (11-22% in 2008-2011). Twee oudere patiënten (63 en 73 jaar) overleden aan respectievelijke een STEC O26-infectie en een niet verder microbiologisch bevestigde STEC-infectie. Vijftien personen ontwikkelden het hemolytisch-uremisch syndroom (HUS (hemolitisch uremisch syndroom)): vijfmaal door STEC O157, eenmaal door een niet typeerbare STEC en negenmaal zonder verdere bevestiging. De incidentie van zowel STEC O157 als STEC non-O157 is de afgelopen jaren langzaam gestegen. De ziektelast van STEC non-O157 is meestal lager dan STEC O157, mede afhankelijk van de specifieke O-groep.
content
Auteur(s): I.H.M. Friesema, W.K. van der Zwaluw, E.G. Biesta-Peters, R. Zuidema, S. Kuiling, I. Jongenburger, D.W. Notermans, W. van Pelt
Infectieziekten Bulletin, jaargang 24, nummer 9, november 2013
content
Inleiding
Shigatoxineproducerende Escherichia coli (STEC (Shigatoxineproducerende E. coli-stammen)), met als meest bekende serogroep O157, is een bekende verwekker van maag-darmklachten met symptomen variërend van ongecompliceerde diarree tot hemorragische colitis en het hemolytisch uremisch syndroom (HUS (hemolitisch uremisch syndroom)). Eén tot 4% van de HUS-patiënten overlijdt in de acute fase aan de ziekte en ongeveer 30% houdt langetermijncomplicaties als gevolg van het syndroom. (1) In totaal kosten STEC O157-infecties in Nederland naar schatting 4,5 tot 9,1 miljoen euro per jaar. (2) Daar komen de kosten voor STEC non-O157- infecties nog bij.
Vanwege de ernst van de ziekte, vooral bij kleine kinderen en ouderen, en het risico op grootschalige uitbraken, is in Nederland in januari 1999 de surveillance van STEC O157 van start gegaan en zijn in december 1999 opgenomen als meldingsplichtige ziekte. In 2007 is de surveillance en meldingsplicht uitgebreid met STEC non-O157, waarbij opgemerkt moet worden dat niet alle Nederlandse laboratoria technieken gebruiken die het mogelijk maken STEC non-O157 te detecteren. Met de conventionele kweek is alleen detectie van STEC O157 mogelijk, bij gebruik van moleculaire detectietechnieken (zoals PCR (polymerase chain reaction)) kunnen ook non-O157-serotypes worden aangetoond. In dit artikel presenteren we de resultaten van de surveillance voor het jaar 2012.
Methoden
Binnen de meldingsplicht dient elke positieve bevinding van STEC (op basis van fecesonderzoek of serologie) door het laboratorium / de arts gemeld te worden aan de lokale GGD (Gemeentelijke Gezondheidsdienst). Daarnaast worden de laboratoria gevraagd om mogelijk STEC-positieve E. coli (Escherichia coli)-stammen op te sturen naar het RIVM. Op het RIVM worden alle ingestuurde STEC O157- en non-O157-isolaten met behulp van polymerase chain reaction (PCR) getest op de aanwezigheid van de belangrijkste virulentiegenen en vervolgens getypeerd middels O- en H-serotypering. Tenslotte worden DNA (deoxyribonucleic acid)-profielen van de STEC O157-isolaten gemaakt door middel van pulsed-field gel electroforese (PFGE (pulsed-field gel electroforese)) om zo stammen onderling met elkaar te kunnen vergelijken en clusters te detecteren.
De GGD verzamelt de basisinformatie over het klinische beeld bij de patiënt en blootstelling aan bekende risicofactoren en geeft dit via Osiris, het officiële meldingsportaal, door aan het RIVM. Daarnaast wordt, waar mogelijk, een langere vragenlijst afgenomen waarin dieper ingegaan wordt op klinisch beeld, gebruik van de gezondheidszorg en risicofactoren. Bij een vermoeden van een bron uit levensmiddelen of door contact met landbouwhuisdieren wordt contact opgenomen met de Nederlandse Voedsel en Waren Autoriteit (NVWA (Nederlandse Voedsel- en Warenautoriteit)) voor bemonstering van levensmiddelen, dierlijke bronnen of omgeving voor onderzoek naar STEC, en typering van eventuele isolaten. Zie voor een uitgebreidere beschrijving van de methode ref (3).
Resultaten
Meldingen
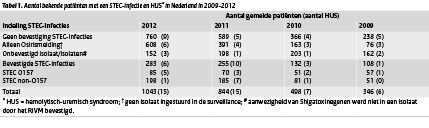
In 2012 waren 1043 patiënten via de aangifte en/of het insturen van een isolaat bij het RIVM bekend. (Tabel 1) Van 435 patiënten werden isolaten naar het RIVM gestuurd, waarvan bij 283 de aanwezigheid van Shigatoxine(stx (shigatoxine)-)genen in de ingestuurde isolaten kon worden bevestigd: 85 O157 en 198 non-O157. Twee patiënten van middelbare leeftijd (73 en 63 jaar) zijn aan de infectie overleden (O26 respectievelijk geen isolaat ingestuurd). Evenals in 2011 zijn er 15 patiënten gemeld die HUS ontwikkelden. Bij 5 patiënten (vier 0-1 jarigen en een 8-jarige) werd een STEC O157- infectie en bij een 81-jarige patiënt een niet-typeerbare STEC-infectie (O NT) vastgesteld. Daarnaast waren er 9 HUS-patiënten zonder serotypering waarvan 7 kinderen (0-15 jaar) en 2 volwassenen (43 en 71 jaar).
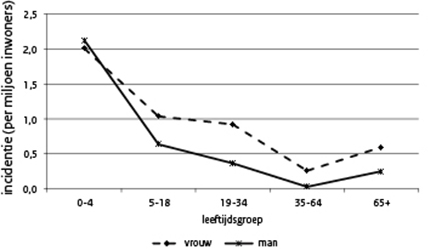
Figuur 1 Incidentie per leeftijdsgroep voor STEC O157, 2012
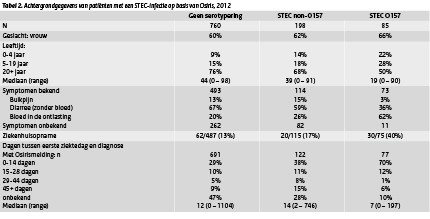
In totaal werden 892 van de 1043 patiënten (86%) gemeld via de aangifte, waarbij het laboratorium in 73% van de gevallen binnen 24 uur de positieve bevinding aan de GGD had doorgegeven. Van 151 patiënten werd alleen een isolaat naar het RIVM ingestuurd, zonder een officiële melding via Osiris: 8 patiënten met een STEC O157-infectie (9% van de O157-infecties), 74 met een STEC non-O157-infectie (37% van de non-O157-infecties) en 69 van wie het ingestuurde isolaat niet als STEC bevestigd kon worden op het RIVM (45% van de niet bevestigde isolaten). Er zijn meer vrouwen met een STEC-infectie dan mannen. (Tabel 2) De patiënten zonder verdere typering zijn gemiddeld het oudst met 76% van deze patiënten 20 jaar of ouder. Het hoogste percentage kinderen is te zien in de groep met een STEC O157-infectie. De patiënten met een STEC O157-infectie hebben het vaakst bloed in de ontlasting en worden regelmatig in het ziekenhuis opgenomen (40%; 1999-2011: 31%-54%). Bij STEC non-O157-infecties uit de infectie zich vooral in de vorm van diarree zonder bloed. Bij 70% van de STEC O157-patiënten zat er maximaal 2 weken tussen eerste ziektedag en diagnosedatum. Bij de 2 andere groepen (STEC non-O157- en niet-bevestigde STEC- infecties) zat er meestal meer tijd tussen en waren de data vaker onbekend.
Tabel 1. Aantal bekende patiënten met een STEC-infectie en HUS* in Nederland in 2009-2012 (klik op tabel voor groot formaat) |
Nader onderzoek naar mogelijke bronnen van infectie
Bij ten minste 6 STEC-patiënten (3x O157, 1x O104 en 2x geen isolaat ingestuurd) was er contact tussen GGD en NVWA. In 4 van de 6 gevallen is voedsel en in 1 geval mest onderzocht op STEC, waarbij geen link met de betreffende patiënt kon worden aangetoond. Bij de zesde patiënt is geen verder onderzoek verricht door de NVWA door het ontbreken van gegevens over een mogelijke bron. Naast deze 6 meldingen hebben 2 GGD'en ook contact opgenomen met de NVWA in verband met een mogelijke verheffing van STEC in hun regio. De NVWA heeft bij deze 2 meldingen geen monsters genomen, aangezien er geen duidelijke bron(nen) waren die onderzocht konden worden. Wel is bij deze meldingen onderzoek gedaan naar een mogelijk gemeenschappelijke factor, levensmiddel, tussen de patiënten van de meldingen, maar door de verspreiding van de patiënten over de regio en de diversiteit in eetpatronen heeft dit niet geleid tot een verdachte bron die bemonsterd kon worden.
Tabel 2. Achtergrondgegevens van patiënten met een STEC-infectie op basis van Osiris, 2012 (klik op tabel voor groot formaat)
STEC O157
In 2012 zijn er 85 patiënten met een STEC O157-infectie gemeld, wat neerkomt op 0,51 per 100.000 inwoners. Dat is opnieuw een stijging ten opzichte van voorgaande jaren: 32-70 patiënten per jaar of 0,22-0,42 ziektegevallen per 100.000 inwoners, exclusief de landelijke uitbraken.
De incidentie van STEC O157-infecties is het hoogst voor kinderen in de leeftijd 0-4 jaar met ongeveer 2 patiëntjes per 100.000 kinderen. (Figuur 1) Daarna daalt de incidentie om weer iets te stijgen onder de 65-plussers. De incidentie ligt voor vrouwen hoger dan voor mannen, behalve bij de jongste leeftijdsgroep. Gemiddeld over de periode 1999-2011 lag de piek van zieken gedurende het jaar in juli (16%) en augustus (19%). In 2012 lag de piek in juni (15%) en juli (21%). Van 42 patiënten werd een vragenlijst ingestuurd (49%). Ruim de helft van de patiënten (52%) heeft rauw of ongaar vlees gegeten, wat een stijging is ten opzichte van voorgaande jaren (Figuur 2). Contact met dieren/mest en contact met een zieke zijn ook gestegen, terwijl het noemen van de consumptie van rauwkost iets is gedaald.
De isolaten van alle 85 STEC O157-patiënten bevatten het stx2-gen, het H7-gen, het E. coli attaching-and-effacinggen (eae (E. coli attaching-and-effacing)) en, bij 84 van de 85 patiënten, het EHEC (Enterohemorragische Escherichia coli) (Enterohemorragische Escherichia Coli)-hemolysinegen (e-hly (hemolysin)); 50 (59%) daarvan bevatten daarnaast het stx1-gen. Vijf isolaten (stx2 positief) waren sorbitolpositief. Met behulp van Pulsed field gel electrophoresis (PFGE) konden 11 clusters in 2012 onderscheiden worden, variërend van 2 tot 6 isolaten per cluster. Bij 4 clusters (2 patiënten, 2x 3 patiënten en 4 patiënten) was een gemeenschappelijke bron niet aannemelijk door de spreiding in tijd of regio. Het vijfde cluster bestond uit 2 HUS-patiëntjes (10 maanden en 8 jaar) die ongeveer 20 kilometer van elkaar afwoonden, maar met circa 5 weken tussen de eerste ziektedagen en geen informatie over mogelijke besmettingsbron. Bij het zesde cluster met 6 patiënten werd de eerste patiënt in april ziek na in Duitsland te zijn geweest en werd de laatste patiënt in juli ziek na in Frankrijk te zijn geweest. De andere 4 patiënten werden in juni ziek en 3 van hen rapporteerden filet américain en/of ossenworst te hebben gegeten, over de vierde patiënt was geen informatie beschikbaar. De laatste 4 clusters waren gezins/familieclusters: een cluster van 2 personen zonder duidelijke bron van besmetting; een familiecluster van 2 personen waarvan 1 van beiden op een veehouderij woonde en de andere daar regelmatig kwam; een gezinscluster van 3 personen, waarbij van 1 van hen de PFGE iets afweek en de besmettingsbron niet bekend was; het laatste PFGE-cluster bestond uit 2 gezinsclusters met beide een HUS-patiënt, bij deze gezinsclusters zat ruim 4 maanden tussen eerste ziektedag. De isolaten van dit laatste cluster van 4 patiënten waren sorbitolpositief.
Figuur 2 Percentage STEC O157-patiënten per risicofactor per jaar (1999-2012), exclusief de STEC O157-patiënten van de uitbraken in 2005, 2007 en 2009
STEC non-O157
Er werden in totaal 198 patiënten gemeld waarbij een STEC non-O157-infectie bij het RIVM bevestigd kon worden, 1 man van 73 jaar is aan de infectie overleden (STEC O26). Aangezien niet alle laboratoria testmethodes gebruiken waarmee alle STEC gedetecteerd kunnen worden, kan de incidentie niet rechtstreeks berekend worden. Vijfentwintig van de 36 in 2012 insturende laboratoria (69%) gebruikten een methode waarmee alle STEC gedetecteerd kan worden. Deze laatste laboratoria waren verantwoordelijk voor 77% van de bevestigde STEC O157-meldingen. De verhouding O157:non-O157 binnen deze laboratoria is 1:3,1. Omgerekend naar heel Nederland zou dit voor 2012 uitkomen op zo’n 260 STEC non-O157-infecties wat correspondeert met een incidentie van 1,6 ziektegevallen per 100.000 inwoners.
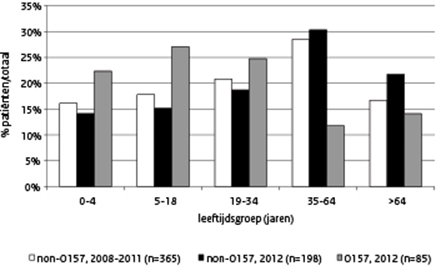
Ongeveer 1 op de 3 STEC non-O157-patiënten is 18 jaar of jonger ten opzichte van ongeveer de helft van de STEC O157- infecties. (Figuur 3) In de jaren 2008-2011 werden de meeste patiënten ziek in de periode mei-september. In 2012 waren er 2 pieken, een in september (16% van de zieken) en een in juni (12% van de zieken). Van 35 patiënten werd een vragenlijst ingestuurd (18%). Evenals de O157-patiënten had meer dan de helft van de patiënten met een STEC non-O157-infectie (54%) rauw of ongaar vlees gegeten. Het aantal patiënten dat zegt contact te hebben gehad met dieren en/of mest was in 2012 (9%) een stuk lager dan in 2009-2011 (22-23%). Consumptie van rauwkost werd door 69% van de patiënten genoemd en contact met een zieke en consumptie van rauwe melk(producten) elk door 6%.
Figuur 3 Percentage patiënten per leeftijdsgroep voor STEC non-O157 (2008-2011 en 2012) en STEC O157 (20120
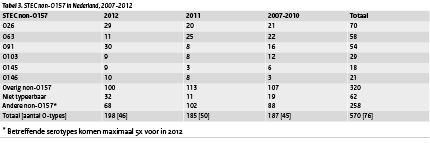
Van de 198 STEC non-O157-isolaten bevatten 88 (44%) isolaten alleen het stx1-gen, 68 (34%) isolaten alleen het stx2-gen (waarvan 21 (11%) het stx2f-gen) en 42 (21%) isolaten bevatten beide genen. In totaal 59 (30%) isolaten hadden heteae- en het e-hly-gen, 24 (12%) isolaten hadden alleen het eae-gen, 70 (35%) isolaten alleen het e-hly-gen en 45 (23%) isolaten geen van beide genen. Van de 198 STEC non-O157-isolaten was 32 keer de O-groep niet typeerbaar en 2 keer was deze autoagglutinabel. Bij de overige 166 isolaten werden 46 verschillende O-groepen gevonden. De O-groepen die in 2012 meer dan 5 keer gevonden werden staan vermeld in tabel 3. De 3 meest gevonden O-groepen in 2012 waren O91, O26 en O63. Over de gehele periode (2007-2012) zijn O26 (n=70), O63 (n=58), O91 (n=54), O113 (n=33) en O103 (n=29) de meest gevonden O-groepen.
Discussie
De incidentie van laboratorium bevestigde STEC O157 is in 2012 opnieuw gestegen ten opzichte van de voorgaande jaren: in 2012 waren er 0,51 patiënten per 100.000 inwoners, in 2011 waren er 0,42 patiënten en in voorgaande jaren 0,22-0,35 per 100.000 inwoners (exclusief uitbraken, 1999-2010). Deze stijging kan (gedeeltelijk) veroorzaakt worden door de introductie van de PCR: de PCR-laboratoria gaan veelal over tot het uitvoeren van een kweek na een positieve PCR en dat lijkt meer positieven te geven dan een kweek voorafgaand aan of zonder gebruik van PCR.
Tabel 3. STEC non-O157 in Nederland, 2007-2012 (klik op tabel voor groot formaat)
Het absolute aantal gemelde STEC non-O157-infecties stijgt elk jaar, deels door een stijging van het aantal laboratoria dat STEC non-O157 kan detecteren. De verhouding O157:non-O157 binnen de laboratoria die testmethodes gebruiken waarmee alle STEC gedetecteerd kunnen worden, lag in de STEC-surveillance tussen 1:2,3 en 1:3,6 (2008-2012). In 2012 was de verhouding 1:3,1 wat een incidentie van 1,6 patiënten per 100.000 inwoners voor Nederland oplevert. De incidentie van STEC non-O157, gebaseerd op het aantal STEC O157 en de geschatte verhouding, is daarmee ook gestegen ten opzichte van de voorgaande jaren: 1,4 patiënten per 100.000 inwoners (2011), 0,7-1,2 per 100.000 inwoners (2008-2010).
In 2012 kon 35% van de naar het RIVM ingestuurde isolaten niet bevestigd en dus niet getypeerd worden en is niet meegeteld in de incidentieberekeningen. Dit percentage laat een daling zien met 2011 (44%) en 2009-2010 (60-61%). Echter, het percentage Osirismeldingen zonder beschikbaar isolaat is gestegen van 22% in 2009 naar 58% in 2012. Er waren maar 8 personen (1-2%) in Osiris gemeld zonder klachten, ten opzichte van 11-49% in 2011. (4) Echter voor 13% (O157), 34% (geen serotypering) en 41% (non-O157) van de meldingen was er geen informatie beschikbaar over de symptomen. Deze daling in inzending van isolaten en het percentage niet-kweekbevestigde isolaten heeft te maken met veranderingen in het omgaan met de meldcriteria en criteria voor inzending voor surveillance.(5) Eén van de aanbevelingen was om isolaten van patiënten met een hoge Ct-waarde (een hogere Ct-waarde duidt op een lagere hoeveelheid STEC-DNA in het monster, verkregen met de real-time PCR) niet meer naar het RIVM te sturen, omdat deze vrijwel nooit bevestigd en dus getypeerd konden worden. Bij deze patiënten werd vervolgens meestal door de GGD geen bron- en contactonderzoek uit-
gevoerd, waardoor ook een deel van de epidemiologische informatie, waaronder soms de klachten, onbekend blijft. Urdahl et al. (6) hebben recent laten zien dat in de ontlasting van 14% van 165 vrijwilligers stx-genen kon worden aangetoond met behulp van PCR, zonder dat er een relatie werd gevonden met leeftijd, geslacht, reizen of diarreeklachten. In een andere studie werden in ontlastingsmonsters van 62 van 100 gezonde vrijwilligers bacteriofagen met stx-genen aangetroffen. (7) Mogelijk dat stx- genen en zelfs STEC als passant in kleine hoeveelheiden in de normale darmflora kan worden gevonden zonder (symptomatische) infectie te veroorzaken. Vooral de incidentie van STEC non-O157 zou daarom een overschatting van de ziekte kunnen zijn. Als je, aan de andere kant, de incidentie wilt hebben van alle infecties, inclusief de mild verlopende infecties, kunnen de hier gegeven incidenties van zowel STEC O157 als non-O157 een onderschatting zijn van de werkelijke incidenties, omdat zelfs bij ziekte niet iedereen dermate ziek zal worden dat hij een arts bezoekt, een arts niet altijd diagnostiek zal aanvragen en bij een laboratoriumaanvraag niet altijd onderzoek gedaan zal worden naar STEC.
De 2 overleden patiënten en de 15 gemelde HUS-patiënten in 2012 laten zien dat een STEC-infectie zeer ernstig kan verlopen. Over het algemeen verloopt een infectie met een STEC non-O157 minder ernstig dan een STEC O157-infectie, maar dit kan variëren per O-groep binnen de STEC non-O157. (4, 8) Van de 6 O-groepen die meer dan vijf keer gevonden zijn binnen de surveillance in 2012, zijn er 4 (O91, O26, O103, O145) geassocieerd met HUS. (8-13) In Nederland komt O63 ook vaak voor, al was dat in 2012 (6% van de STEC non-O157) minder vaak dan in de voorgaande jaren (14% 2011, 12% 2007-2010). Bijzonder aan O63 is dat dit type altijd het stx2f-gen bezit. Analyse van STEC non-O157 met het stx2f-gen (n=87) liet zien dat stx2f STEC-infecties milder verlopen dan een infectie met een andere STEC non-O157 of STEC O157. (Ingediend voor publicatie) Alleen de STEC O157-infecties in Nederland kosten naar schatting al 4,5 tot 9,1 miljoen euro per jaar. (2) De kosten voor alle STEC-infecties zullen daar ruim boven liggen. Voorlichting over de risico’s bij contact met dieren en over risicovolle voedselproducten zou kunnen helpen het aantal infecties, en daarmee de kosten, omlaag te brengen.
Door de invoering van de PCR voor diagnostiek bij patiënten met diarree-achtige klachten is het aantal meldingen van STEC aanzienlijk gestegen, waarbij in een grote groep geen gekweekt isolaat van de STEC beschikbaar is. Ook ontstaat er steeds meer twijfel of alle STEC-positieve PCR-resultaten relevant zijn voor de publieke gezondheid (geen duidelijke klachten, geen acute klachten).(5) Momenteel worden er, voornamelijk op lokaal of regionaal niveau, pragmatische keuzes gemaakt welke STEC-positieve PCR-resultaten wel en welke niet relevant zijn. Dit uit zich in meldingen met alleen basisgegevens over de patiënt en bijvoorbeeld geen informatie over symptomen en risicofactoren, en meldingen zonder dat een isolaat naar het RIVM voor typering wordt gestuurd. Op dit moment loopt er een project in 2 regio’s, met een deel laboratoriumdiagnostiek en een GGD-deel, om een wetenschappelijk onderbouwd keuze algoritme op te stellen en waar nodig richtlijnen voor meldingsplicht en bron-contactonderzoek aan deze keuzes aan te passen. De resultaten van het project worden in 2014 verwacht.(14)
Geconcludeerd wordt dat STEC non-O157-infecties in Nederland wat betreft vóórkomen minstens zo belangrijk zijn als STEC O157-infecties. Het aantal STEC O157- en non-O157-infecties in Nederland is gestegen ten opzichte van voorgaande jaren. Wat betreft ziektelast lijken de STEC non-O157-infecties gemiddeld een minder ernstig verloop te hebben, wat echter mede afhankelijk is van de O-groep.
Alle GGD'en en medisch microbiologische laboratoria worden hartelijk bedankt voor hun medewerking bij de verzameling van de patiëntgegevens en het insturen van isolaten. Daarnaast worden de medewerkers van de NVWA bedankt voor het bemonsteren van en onderzoek naar landbouwhuisdieren en verdacht voedsel.
Auteurs
I.H.M. Friesema1, W.K. van der Zwaluw1, E.G. Biesta-Peters3, R. Zuidema1 , S. Kuiling1, I. Jongenburger3, D.W. Notermans1, W. van Pelt1
1. Centrum Infectieziektebestrijding, RIVM, Bilthoven
2. Nederlandse Voedsel en Waren Autoriteit, Wageningen
Correspondentie
ingrid.friesema@rivm.nl
- Spinale JM (Joint meeting), Ruebner RL (richtlijn), Copelovitch L, Kaplan BS. Long-term outcomes of Shiga toxin hemolytic uremic syndrome. Pediatr Nephrol 2012 (article in press).
- Tariq L, Haagsma J, Havelaar A. Cost of Illness and Disease Burden in The Netherlands Due to Infections with Shiga Toxin-Producing Escherichia coli O157. J Food Prot 2011; 74: 545-52.
- Friesema IHM, de Jager CM, Heuvelink AE (alveolaire echinokokkose), et al. Intensieve surveillance van Shiga toxine producerende Escherichia coli in Nederland, 2009. Infectieziekten Bulletin 2011; 22: 22-9.
- Friesema IHM, Van der Zwaluw WK, Biesta-Peters EG (Europese Gemeenschap), Kuiling S, Van Pelt W. Surveillance van STEC (Shigatoxineproducerende E. coli-stammen) in Nederland, 2011. Infectieziekten Bulletin 2013; 24: 79-83.
- Lede IO, Kraaij-Dirkzwager MM, van den Kerkhof JHTC, Notermans DW. Gebrek aan uniformiteit bij meldingen van Shigatoxineproducerende Escherichia coli en Shigella aan en door GGD (Gemeentelijke Gezondheidsdienst)-en. Infectieziekten Bulletin 2012; 23: 116-8.
- Urdahl AM, Solheim HT, Vold L, Hasseltvedt V, Wasteson Y. Shiga toxin-encoding genes (stx (shigatoxine) genes) in human faecal samples. APMIS 2013; 121: 202-10.
- Martinez-Castillo A, Quirós P, Navarro F, Miró E, Muniesa M. Shiga toxin 2-encoding bacteriophages in human fecal samples from healthy individuals. Appl Environ Microbiol 2013; 79: 4862-8.
- Gould LH, Mody RK, Ong KL, et al. Increased Recognition of Non-O157 Shiga Toxin-Producing Escherichia coli Infections in the United States During 2000-2010: Epidemiologic Features and Comparison with E. coli (Escherichia coli) O157 Infections. Foodborne Pathog Dis 2013; 10: 453-60.
- Bonnet R, Souweine B, Gauthier G, et al. Non-O157: H7 Stx2-producing Escherichia coli strains associated with sporadic cases of hemolytic-uremic syndrome in adults. J Clin Microbiol 1998; 36: 1777-80.
- Mellmann A, Fruth A, Friedrich AW, et al. Phylogeny and disease association of Shiga toxin-producing Escherichia coli O91. Emerg Infect Dis 2009; 15: 1474-7.
- Bielaszewska M, Mellmann A, Bletz S, et al. Enterohemorrhagic Escherichia coli O26:H11/H- : A New Virulent Clone Emerges in Europe. Clin Infect Dis 2013; 56: 1373-81.
- Rosales A, Hofer J, Zimmerhackl LB, et al. Need for Long-term Follow-up in Enterohemorrhagic Escherichia coli-Associated Hemolytic Uremic Syndrome Due to Late-Emerging Sequelae. Clin Infect Dis 2012; 54: 1413-21.
- Käppeli U, Hächler H, Giezendanner N, Beutin L, Stephan R. Human infections with non-o157 Shiga toxin-producing Escherichia coli, Switzerland, 2000-2009. Emerg Infect Dis 2011; 17: 180-5.
- Kooistra-Smid AMD, de Boer RF, Croughs PD, et al. Nieuw onderzoek naar diagnostiek van STEC en HUSEC (hemolytisch uremisch syndroom E. coli): STEC-ID (individuele dosis)-net. Ned Tijdschr Med Microbiol 2013; 21: 70-3.